题目内容
在相同温度下,已知2H2(g)+O2(g)=2H2O(g)△H1; 2H2(g)+O2(g)=2H2O(l)△H2;H2(g)+
O2(g)=H2O(l)△H3,则△H1、△H2、△H3大小关系为( )
| 1 |
| 2 |
| A、△H1=△H2=△H3 |
| B、2△H3=△H2>△H1 |
| C、△H3>△H2>△H1 |
| D、2|△H3|=|△H2|>|△H1| |
考点:反应热的大小比较
专题:化学反应中的能量变化
分析:氢气完全燃烧生成液态水比生成气态水放出的热量多,因为液态水变为气态水需要吸热.燃烧2mol氢气是燃烧1mol氢气生成液态水放出的热量的2倍,以此解答该题.
解答:
解:因为液态水变为气态水需要吸热,则气完全燃烧生成液态水比生成气态水放出的热量多,但△H<0,则△H2<△H1,燃烧2mol氢气是燃烧1mol氢气生成液态水放出的热量的2倍,2△H3=△H2,所以2|△H3|=|△H2|>|△H1|,
故选D.
故选D.
点评:本题考查反应热大小的比较,题目难度不大,本题注意把握比较反应热大小的方法.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、浓硝酸保存在玻璃塞的棕色试剂瓶中 |
| B、已经完成定容的500mL 1.0mol?L-1 的NaOH溶液,某同学不慎将容量瓶中溶液洒出,只能重新配制 |
| C、导管口点燃CO时需要验纯,H2加热还原CuO时也需要验纯 |
| D、物质溶于水的过程中,一般有放热或吸热现象,因此溶解的操作不能在量筒中进行 |
下列有关营养成分与人体健康关系叙述错误的是( )
| A、缺铁会患贫血症 |
| B、为防治佝偻病,过量补钙 |
| C、摄入糖分不足,会患低血糖 |
| D、缺碘人群可多食用海带、虾皮等含碘丰富的食物 |
下列说法正确的是( )
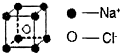

| A、1mol白磷晶体中含有的P-P键的个数为4NA |
| B、12g金刚石中含有的C-C键的个数为1.5NA |
| C、12g石墨烯(单层石墨)中含有六元环的个数为0.5NA |
| D、1mol氯化钠(晶胞如图)中含有Na+数目为8NA |
下列有关说法正确的是( )
| A、CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 |
| B、电镀时常采用镀层金属作阳极,镀件作阴极 |
| C、复合肥(如磷酸氢二铵)和生石灰能一起施用 |
| D、水的离子积常数K,随着温度的升高而增大,说明水的电离是放热反应 |
下列说法正确的是( )
| A、O2的摩尔质量为32g |
| B、22.4LCO和H2的混合气体所含分子数为NA |
| C、0.1molN2和O2的混合气体在标准状况下的体积为2.24L |
| D、若1 molCO2所占体积为22.4L,则其所处状况一定为标准状况 |