题目内容
常温常压下,现有浓度为0.100mol/L的六种溶液:①HCl,②H2SO4,③CH3COOH,④CH3COONa ⑤NaOH,⑥Na2CO3由水电离出的C(H+)大小关系正确的是( )
| A、⑥>④>③>①=⑤>② |
| B、①=②>③>⑥>④>⑤ |
| C、②>①>③>④>⑥>⑤ |
| D、④>⑥>③>①=⑤>② |
考点:盐类水解的原理,水的电离
专题:电离平衡与溶液的pH专题
分析:酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中氢离子浓度越大或碱中氢氧根离子浓度越大,则抑制水电离程度越大,弱酸根离子水解程度越大,则促进水电离程度越大,据此分析解答.
解答:
解:酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中氢离子浓度越大或碱中氢氧根离子浓度越大,则抑制水电离程度越大,弱酸根离子水解程度越大,则促进水电离程度越大,①②③是酸、⑤是碱抑制水电离,②中氢离子浓度最大、①中氢离子浓度和⑤中氢氧根离子浓度相等、③中氢离子浓度最小,所以这几种物质抑制水电离程度大小顺序是③<①=⑤<②;④⑥是含有弱离子的盐促进水电离,碳酸根离子水解程度大于醋酸根离子,所以促进水电离程度⑥>④,
通过以上分析知,由水电离出的C(H+)大小关系正确的是⑥>④>③>①=⑤>②,
故选A.
通过以上分析知,由水电离出的C(H+)大小关系正确的是⑥>④>③>①=⑤>②,
故选A.
点评:本题以弱电解质的电离、盐类水解为载体考查水的电离影响,明确水电离本质是解本题关键,根据溶液中氢离子或氢氧根离子浓度变化确定抑制还是促进水电离,题目难度中等.

练习册系列答案
相关题目
某学生将溴乙烷和NaOH溶液共热煮沸几分钟后,冷却,滴入AgNO3溶液,结果未见到预期的现象,其主要原因是( )
| A、加热时间太短 |
| B、加AgNO3溶液前未用稀HNO3酸化 |
| C、应该和NaOH的乙醇溶液共热 |
| D、不应该冷却后再滴入AgNO3溶液 |
夏天戴墨镜能阻止阳光直射眼镜,但是进入室内时马上会感觉光线太暗,一副变色眼镜能很好地解决这个问题,它能随着光线的强弱自动调节镜片颜色的深浅.将下列哪种物质和微量氧化铜一起添加到玻璃中能得到上述可变色的眼镜镜片( )
| A、硝酸银 | B、单质碘 |
| C、溴化银 | D、硫酸铜 |
常温下,现有1mL c1 mol/L的醋酸溶液和1mL c2mol/L的氢氧化钠溶液.下列说法中正确的是( )
| A、若c1=c2,则醋酸溶液中的c(H+)与氢氧化钠溶液中的c(OH-)相同 |
| B、若醋酸溶液的pH=3,氢氧化钠溶液的pH=11,则醋酸溶液中的c(CH3COO-)与氢氧化钠钠溶液中的c(Na+)相同 |
| C、将醋酸溶液与氢氧化钠溶液混合,若c1=c2,则所得溶液的pH=7 |
| D、将醋酸溶液与氢氧化钠溶液混合,若所得混合溶液的pH=7,则混合液中c(CH3COO-)>c(Na+) |
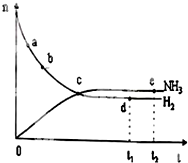 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A、点a的逆反应速率比点b的大 |
| B、点c处反应达到平衡 |
| C、点d(t1时刻)和点e(t2时刻)处H2的转化率相同 |
| D、点d(t1时刻)和点e(t2时刻)处n(N2)不一样 |
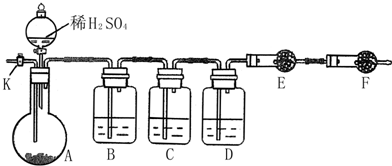 为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g 以如图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)
为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g 以如图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)