题目内容
7.图是周期表中短周期的部分元素,图中数据表示元素原子得电子的能力.
(1)表中数据越大,表示该元素越易(填“难”或“易”)形成阴离子.
(2)一般来讲,两元素数据值差大于1.7时,形成离子键;小于1.7时形成共价键.则g、d组成的化合物中形成的化学键为离子键,a、h组成的化合物中化学键类型为共价键.
(3)f原子的价电子排布式为1s22s22p63s2,c元素属于元素周期表的五个区域(s区、p区、d区、ds区、f区)中的p区.
分析 (1)图中数据表示元素原子得电子的能力,数据越大说明越易得到电子,越易形成阴离子;
(2)g为1.61,d为3.44,相差1.83,a为0.98,h为2.58,相差1.60,根据两元素数据值差大于1.7时,形成离子键,小于1.7时形成共价键判断;
(3)f为镁,12号元素,据此书写电子排布式,根据电子最后填入的能级判断元素的分区.
解答 解:(1)图中数据表示元素原子得电子的能力,数据越大说明越易得到电子,越易形成阴离子,故答案为:易;
(2)g为1.61,d为3.44,相差1.83,形成离子键;a为0.98,h为2.58,相差1.60,形成共价键,故答案为:离子键;共价键;
(3)f为镁,12号元素,电子排布式为1s22s22p63s2,c为N元素,电子最后填入的能级为p,故为p区元素,故答案为:1s22s22p63s2;p.
点评 本题主要考查元素的性质,明确表格的数值与非金属性的关键是解答本题的关键,较好的考查学生对表格中的数据分析整合、处理应用的能力,难度不大.

练习册系列答案
相关题目
11.漂白粉的有效成分是( )
| A. | Ca(ClO)2 | B. | CI2 | C. | CaCl2 | D. | Ca(OH)2 |
12.下列反应中,调节反应物的用量或浓度以后,不会改变反应产物的是( )
| A. | 酒精在氧气中燃烧 | B. | 在硫酸中加入铝粉 | ||
| C. | 将二氧化碳气体通入烧碱中 | D. | 向盐酸中加入铁钉 |
15.下列有关实验的说法正确的是( )
| A. | 将实验完剩余的金属钠放回原试剂瓶中 | |
| B. | 测定熔融氢氧化钠的导电性,可在铁质坩埚中熔化氢氧化钠固体后进行测量 | |
| C. | 制备Fe(OH)3胶体通常是将饱和氯化铁溶液煮沸,直至呈红褐色时停止加热 | |
| D. | 在饱和NaOH溶液中加一定量Na2O2,充分反应后恢复到原温度,有晶体析出,溶液质量不变 |
12.化学无处不在,下列与化学相关的说法不正确的是( )
| A. | 碘是人体必需微量元素,所以应多吃富含高碘酸的食物 | |
| B. | “血液透析”运用了胶体的性质 | |
| C. | 过氧化钠可作为高空飞行或潜水装置中的供氧剂 | |
| D. | 大力开发太阳能、风能、水能等新能源,减少煤、石油等化石燃料的使用,有利于实现“低碳经济” |
19.科学家预测原子序数为114的元素,它的位置在第7周期IVA族,称为类铅.关于它的性质,预测错误的是( )
| A. | 它的最外层电子数为4 | B. | 它的金属性比铅强 | ||
| C. | 它具有+2、+4价 | D. | 它的最高价氧化物的水化物是强酸 |
16.A、B、C、D、E、F六种元素,其中ABCDE为短周期元素,①原子半径A<C<B<E<D②原子最外层电子数A=D、C=E、A+B=C③原子的核外电子层数B=C=2A④B元素的最高正价与最低负价数值之差为2⑤F在地壳中金属元素含量第二,下列说法正确的是( )
| A. | 因为C的氢化物分子内含有氢键,所以比E的氢化物稳定 | |
| B. | 过量F与氯气加热完全反应,得到相应的低价态氯化物 | |
| C. | 因为E单质相对分子量小于溴单质的相对分子量,所以E单质熔点比溴低 | |
| D. | A、D形成化合物的水溶液呈碱性 |
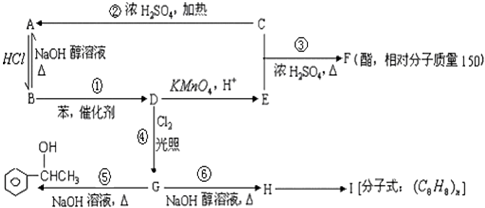

 ;③
;③ +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$ +H2O;⑥
+H2O;⑥ .
.