题目内容
15.下列有关实验的说法正确的是( )| A. | 将实验完剩余的金属钠放回原试剂瓶中 | |
| B. | 测定熔融氢氧化钠的导电性,可在铁质坩埚中熔化氢氧化钠固体后进行测量 | |
| C. | 制备Fe(OH)3胶体通常是将饱和氯化铁溶液煮沸,直至呈红褐色时停止加热 | |
| D. | 在饱和NaOH溶液中加一定量Na2O2,充分反应后恢复到原温度,有晶体析出,溶液质量不变 |
分析 A.钠性质活泼,易与水、氧气反应,若在实验室随意丢弃,易引起火灾;
B.瓷坩埚中含有二氧化硅,在加热条件下能与氢氧化钠反应,而铁坩埚不与熔融氢氧化钠反应;
C.将饱和氯化铁溶液逐滴滴入沸水中直至变成红褐色可制备Fe(OH)3胶体;
D.由于过氧化钠与水反应,消耗了溶剂,导致溶液质量减小.
解答 解:A.因钠活泼,易与水、氧气反应,若在实验室随意丢弃,可引起火灾,实验时剩余的钠粒可放回原试剂瓶中,故A正确;
B.熔融氢氧化钠能够与瓷坩埚中的二氧化硅反应,则测定熔融氢氧化钠的导电性,应该在铁质坩埚中熔化氢氧化钠固体后进行测量,故B正确;
C.制备Fe(OH)3胶体的正确方法是:将饱和氯化铁溶液逐滴滴入沸水中直至变成红褐色,故C错误;
D.在饱和NaOH溶液中加一定量Na2O2,充分反应后恢复到原温度,有晶体析出,由于过氧化钠消耗了水,导致反应后溶液的质量减小,故D错误;
故选AB.
点评 本题考查化学实验方案的评价,涉及化学试剂的保存、氢氧化铁胶体的制备、饱和溶液特点等知识,明确常见元素及其化合物性质为解答关键,注意掌握氢氧化铁胶体的制备方法,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
相关题目
19.下列实验操作要求中,主要是从实验安全方面考虑的是( )
| A. | 实验剩余的药品不能放回原试剂瓶 | |
| B. | 点燃可燃性气体前必须验纯 | |
| C. | 气体实验装置在实验前要进行气密性检查 | |
| D. | 滴管不能交叉使用 |
20.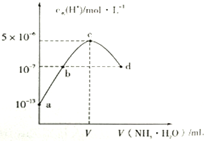 常温下,向20mL某浓度的硫酸溶液中滴入0.1mol/L氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( )
常温下,向20mL某浓度的硫酸溶液中滴入0.1mol/L氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( )
 常温下,向20mL某浓度的硫酸溶液中滴入0.1mol/L氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( )
常温下,向20mL某浓度的硫酸溶液中滴入0.1mol/L氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( )| A. | V=40 | |
| B. | C点所示溶液中:c(H+)-c(OH-)═2c(NH3.H2O) | |
| C. | NH3.H2O的电离常数K=10-4 | |
| D. | d点所示溶液中:c(NH4+)═2c(SO42-) |
10.下列物质中含有的杂质(括号内为杂质),不可以用加热的方法除去的是( )
| A. | CaCO3(CaO) | B. | Na2O2(Na2O) | C. | Na2CO3(NaHCO3) | D. | MgO[Mg(OH)2] |
20.下列A、B、C、D、E、F为几种常见仪器的部分结构(有的仪器被放大)
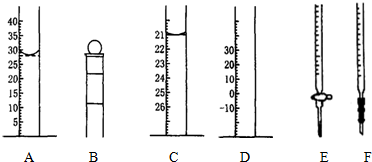
(1)A图中液面所示溶液的体积为28.0mL
(2)仪器E的名称是酸式滴定管
(3)Na2S2O3(硫代硫酸钠),俗称大苏打.把Na2S2O3•5H2O固体溶于水,得到无色溶液,该溶液显碱性,用离子反应方程式解释溶液显碱性的原因:S2O32?+5H2O?HS2O3?+0H?.化工生产中常常依据反应2S2O32-+I2=S4O62-+2I-,用I2的标准溶液测定大苏打产品的纯度.步骤如下:
①称取5.5g Na2S2O3•5H2O产品,用仪器B(从上述A、B、C、D、E、F中选填)配制成100.00mL溶液.
②用仪器F(从上述A、B、C、D、E、F中选填)量取10.00mL溶液于锥形瓶中,以淀粉溶液为指示剂.
③用浓度为0.0500mol/L的I2标准溶液进行滴定,判断达到滴定终点的现象是锥形瓶中的溶液由无色溶液变成蓝色,且半分钟不褪色.
④重复滴定3次,数据记录于表.计算所配制的Na2S2O3溶液的物质的量浓度为(保留4位小数)0.2000mol/L
⑤滴定时若用Na2S2O3溶液润洗锥形瓶,则测得大苏打产品的浓度偏高(填偏高、偏低、不变).

(1)A图中液面所示溶液的体积为28.0mL
(2)仪器E的名称是酸式滴定管
(3)Na2S2O3(硫代硫酸钠),俗称大苏打.把Na2S2O3•5H2O固体溶于水,得到无色溶液,该溶液显碱性,用离子反应方程式解释溶液显碱性的原因:S2O32?+5H2O?HS2O3?+0H?.化工生产中常常依据反应2S2O32-+I2=S4O62-+2I-,用I2的标准溶液测定大苏打产品的纯度.步骤如下:
①称取5.5g Na2S2O3•5H2O产品,用仪器B(从上述A、B、C、D、E、F中选填)配制成100.00mL溶液.
②用仪器F(从上述A、B、C、D、E、F中选填)量取10.00mL溶液于锥形瓶中,以淀粉溶液为指示剂.
③用浓度为0.0500mol/L的I2标准溶液进行滴定,判断达到滴定终点的现象是锥形瓶中的溶液由无色溶液变成蓝色,且半分钟不褪色.
④重复滴定3次,数据记录于表.计算所配制的Na2S2O3溶液的物质的量浓度为(保留4位小数)0.2000mol/L
| 编号 | 1 | 2 | 3 | 4 |
| Na2S2O3溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 20.01 | 20.02 |
4.下列反应类型说法不正确的是( )
| A. | 2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2 氧化还原反应 | |
| B. | N2+3H2$?_{高温高压}^{催化剂}$2NH3可逆反应 | |
| C. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl 置换反应 | |
| D. | CH2=CH2+Br2→CH2Br-CH2Br 加成反应 |
5.已知X、Y、Z、W是原子序数依次增大的短周期主族元素,X最外层电子数是次外层电子数的2倍,Y和W同主族,且W的原子序数是Y的2倍,Z的焰色反应为黄色.下列说法不正确的是( )
| A. | 原子半径大小顺序:r(Z)>r(W)>r(Y) | |
| B. | Y的简单气态氢化物的热稳定性比W的强 | |
| C. | Z和Y形成的原子个数比为1:1和2:1的化合物中化学键类型相同 | |
| D. | X的最高价氧化物对应水化物的酸性比W的弱 |
