题目内容
【题目】煤的气化主要生成CO、H2等,其中CO、H2是用途相当广泛的化工基础原料。但煤的气化获得的化工原料气中常含有少量羰基硫(COS),能引起催化剂中毒、大气污染等。
(1)COS的电子式为_____________________。
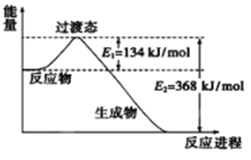
(2)下图是1molCO和lmolNO2反应生成两种气态氧化物过程屮能量变化示意图。已知14克CO参加反应时转移电子数为NA。写出该反应的热化学方程式_______________________。
(3)在某一恒温、恒容的密闭容器中发生以下反应:Ni(S)+4CO(g) ![]() Ni(CO)4(g)。下列说法正确的是__________。
Ni(CO)4(g)。下列说法正确的是__________。
A.该反应的反应热△H<0
B.增加Ni的量可提高CO的转化率,Ni的转化率降低
C.反应达到平衡后,充入CO再次达到平衡时,CO的浓度增大
D.当v正[Ni(CO)4]=4v逆(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衝状态
(4)工业上采用CO与H2反应合成甲醇,反应如下CO(g)+2H2(g)![]() CH3OH(g)。在T℃时,将2molCO和amolH2充入2L的恒容密闭容器中充分反应,l0min后反应达到平衡。已知v(CH3OH)=0.05molL-1min-1,且CO和H2的转化率相等。
CH3OH(g)。在T℃时,将2molCO和amolH2充入2L的恒容密闭容器中充分反应,l0min后反应达到平衡。已知v(CH3OH)=0.05molL-1min-1,且CO和H2的转化率相等。
①H2的转化率为_________________,反应未开始时的容器内气体压强P1与反应达平衡时压强P2的比值为__________________。
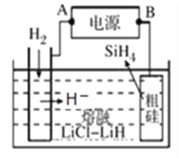
②以甲醇燃料电池为电源,熔融盐电解法制取硅烷原理如图。阳极的电极反应式为_______________。
(5)甲醇可制备二甲醚:2CH3OH(g)![]() CH3OCH3(g)+ H2O(g),K =1 (300℃测定)。
CH3OCH3(g)+ H2O(g),K =1 (300℃测定)。
①在300℃时,测得n(CH3OCH3)=2n(CH3OH),此时反应的v正__________v逆(填“〉”、“〈”或“=”〉,你的分析理由是___________________。
②二甲醚催化重整制氢的反应过程,主要包括以下几个反应(以下数据为25℃、1.01×l05Pa测定):
Ⅰ:CH3OCH3(g)+H2O(1)![]() 2CH3OH(1)△H>0
2CH3OH(1)△H>0
Ⅱ:CH3OH(1)+H2O(1)![]() CO2(g)+3H2(g)△H>0
CO2(g)+3H2(g)△H>0
Ⅲ:CO(g)+H2O(1)![]() CO2(g)+H2(g)△H<0
CO2(g)+H2(g)△H<0
Ⅳ:CH3OH(l)![]() CO(g)-2H2(g)△H>0
CO(g)-2H2(g)△H>0
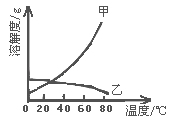
工业生产中测得不同温度下各组分体积分数及二甲醚转化率的关系如下图所示,
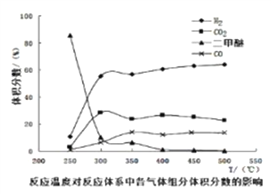

你认为反应控制的最佳温度应为__________。
A. 300350℃ B. 35040℃ C. 400450℃ D. 450500℃
【答案】 ![]() NO2(g)+CO(g)=CO2(g)+NO(g) △H=-234kJ/mol AC 50% 3∶2 Si+4H+-4e-=SiH4 < Qc=
NO2(g)+CO(g)=CO2(g)+NO(g) △H=-234kJ/mol AC 50% 3∶2 Si+4H+-4e-=SiH4 < Qc=![]() =4>1,此时反应向逆向进行,所以 v正逆 C
=4>1,此时反应向逆向进行,所以 v正逆 C
【解析】(1)COS与CO2是等电子体,结构相似,电子式为![]() ;1molCO和lmolNO2反应生成两种气态氧化物,CO2和NO,14克CO参加反应时转移电子数为NA。 NO2(g)+CO(g)=CO2(g)+NO(g) △H=(134-368)kJ/mol=-234kJ/mol;(3)A.升高温度,向逆向进行,该反应的反应热△H<0,故A正确;B.Ni是固体,增加Ni的量不能提高CO的转化率,故B错误;C.反应达到平衡后,充入CO再次达到平衡时,CO的转化率降低,CO的浓度增大,故C正确;D.当v正[Ni(CO)4]=1/4v逆(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衝状态,故D错误;故选AC。(4)①生的CH3OH为0.05molL-1min-1×10min×2L=1mol,反应的CO为1mol,CO和H2的转化率相,1mol/2mol×100%=50%,H2的转化率为50%;a=4mol,平衡时各物质的量为1molCO、2molH2,1molCH3OH,反应未开始时的容器内气体压强P1与反应达平衡时压强P2的比值为(2+4)/(1+2+1)=3:2;②以甲醇燃料电池为电源,熔融盐电解法制取硅烷,阳极硅失电子发生氧化反应,电极反应式为 Si+4H+-4e-=SiH4 ;(5)甲醇可制备二甲醚:2CH3OH(g)
;1molCO和lmolNO2反应生成两种气态氧化物,CO2和NO,14克CO参加反应时转移电子数为NA。 NO2(g)+CO(g)=CO2(g)+NO(g) △H=(134-368)kJ/mol=-234kJ/mol;(3)A.升高温度,向逆向进行,该反应的反应热△H<0,故A正确;B.Ni是固体,增加Ni的量不能提高CO的转化率,故B错误;C.反应达到平衡后,充入CO再次达到平衡时,CO的转化率降低,CO的浓度增大,故C正确;D.当v正[Ni(CO)4]=1/4v逆(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衝状态,故D错误;故选AC。(4)①生的CH3OH为0.05molL-1min-1×10min×2L=1mol,反应的CO为1mol,CO和H2的转化率相,1mol/2mol×100%=50%,H2的转化率为50%;a=4mol,平衡时各物质的量为1molCO、2molH2,1molCH3OH,反应未开始时的容器内气体压强P1与反应达平衡时压强P2的比值为(2+4)/(1+2+1)=3:2;②以甲醇燃料电池为电源,熔融盐电解法制取硅烷,阳极硅失电子发生氧化反应,电极反应式为 Si+4H+-4e-=SiH4 ;(5)甲醇可制备二甲醚:2CH3OH(g)![]() CH3OCH3(g)+ H2O(g),K =1 (300℃测定)。①在300℃时,测得n(CH3OCH3)=2n(CH3OH),此时反应的v正逆,理由是Qc=
CH3OCH3(g)+ H2O(g),K =1 (300℃测定)。①在300℃时,测得n(CH3OCH3)=2n(CH3OH),此时反应的v正逆,理由是Qc=![]() =4>1,此时反应向逆向进行,所以 v正逆;② 400450℃二甲醚的转化率较高,再升高温度,增大成本,转化率提高有限,温度太低,反应速率太慢。
=4>1,此时反应向逆向进行,所以 v正逆;② 400450℃二甲醚的转化率较高,再升高温度,增大成本,转化率提高有限,温度太低,反应速率太慢。