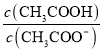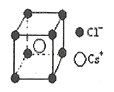题目内容
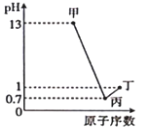
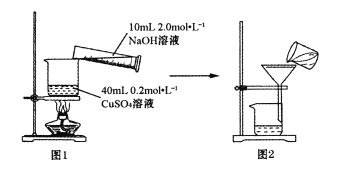
【题目】若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是( )
A.0.2mol/LNH4HCO3溶液(pH>7):c(![]() )>c(
)>c(![]() ),c(H2CO3)>c(NH3H2O)
),c(H2CO3)>c(NH3H2O)
B.0.2mol/L氨水:0.2mol/L>c(OH-)+ c(NH3H2O)
C.向0.1mol/LNH4HCO3溶液中通入CO2至溶液pH=7:c(![]() )=c(
)=c(![]() )+c(
)+c(![]() )
)
D.pH=2的盐酸与pH=12的氨水等体积混合:c(![]() )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
【答案】AD
【解析】
A.在0.2mol/LNH4HCO3溶液中发生阴、阳离子的水解反应:![]() +H2O
+H2O![]() NH3·H2O + H+、
NH3·H2O + H+、![]() +H2O
+H2O![]() H2CO3+OH-,由于溶液的pH>7,
H2CO3+OH-,由于溶液的pH>7,![]() 的水解程度小于
的水解程度小于![]() 的水解程度,从而导致溶液中c(
的水解程度,从而导致溶液中c(![]() )减少更多,所以c(
)减少更多,所以c(![]() )>c(
)>c(![]() ),c(H2CO3)>c(NH3H2O),A正确;
),c(H2CO3)>c(NH3H2O),A正确;
B.在0.2mol/L氨水中,存在下列物料守恒:c(![]() )+c(NH3H2O)=0.2mol/L,由于c(OH-)= c(
)+c(NH3H2O)=0.2mol/L,由于c(OH-)= c(![]() )+c(H+),所以c(OH-)+ c(NH3H2O)>0.2mol/L,B不正确;
)+c(H+),所以c(OH-)+ c(NH3H2O)>0.2mol/L,B不正确;
C.向0.1mol/LNH4HCO3溶液中通入CO2至溶液pH=7,此时溶液中满足电荷守恒,从而得出c(![]() )+c(H+)=c(
)+c(H+)=c(![]() )+2c(
)+2c(![]() )+c(OH-),由于pH=7,所以c(H+)=c(OH-),c(
)+c(OH-),由于pH=7,所以c(H+)=c(OH-),c(![]() )=c(
)=c(![]() )+2c(
)+2c(![]() ),C不正确;
),C不正确;
D.pH=2的盐酸与pH=12的氨水等体积混合,发生中和反应后,溶液中的溶质为NH4Cl和NH3H2O,此时主要发生如下电离:NH4Cl==![]() +Cl-、NH3·H2O
+Cl-、NH3·H2O![]()
![]() + OH-、H2O
+ OH-、H2O![]() H++OH-,且NH3·H2O的电离程度较小,所以c(
H++OH-,且NH3·H2O的电离程度较小,所以c(![]() )>c(Cl-)>c(OH-)>c(H+),D正确;
)>c(Cl-)>c(OH-)>c(H+),D正确;
故选AD。

【题目】已知元素N、S、![]() 可形成多种物质,在工业生产上有着广泛的应用。请回答下列问题:
可形成多种物质,在工业生产上有着广泛的应用。请回答下列问题:
(1)Se与S是同族元素,请写出基态Se原子的电子排布式:__。N与S是不同族元素,请解释NH3在水中的溶解度比H2S大的原因:__。
(2)有一种由1~9号元素中的部分元素组成,且与SCl2互为等电子体的共价化合物,它的分子式为__。借助等电子体原理可以分析出SCN-中σ键和π键的个数比为__。
(3)已知![]() 的结构为
的结构为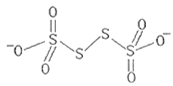 其中S原子的杂化方式是__。
其中S原子的杂化方式是__。
(4)N、P可分别形成多种三角锥形分子,已知NH3的键角大于PH3,原因是__。
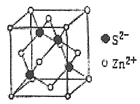
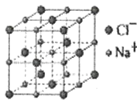
(5)离子晶体中阳离子和阴离子的半径比不同可形成不同的晶胞结构,见下表:
半径比 | 0.225~0.414 | 0.414~0.732 | 0.732~1 |
典型化学式 | 立方ZnS | NaCl | CsCl |
晶胞 |
|
|
|
已知某离子晶体RA,其阴阳离子半径分别为184pm和74pm,摩尔质量为Mg/mol,则阳离子配位数为__,晶体的密度为__g/cm3(列出计算式,无需化简,设NA为阿伏加德罗常数的值)。