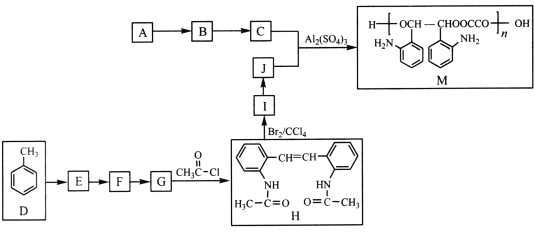
题目内容
【题目】二氧化氯(![]() )具有强氧化性,
)具有强氧化性,![]() 协同氨法同时脱硫脱硝具有高脱除率。
协同氨法同时脱硫脱硝具有高脱除率。
(1)![]() 单独参与脱硝过程中发生以下反应:
单独参与脱硝过程中发生以下反应:
![]()
![]()
![]()
![]()
![]()
![]()
则反应![]() 的
的![]() ________
________![]()
(2)![]() 的浓度、吸收液
的浓度、吸收液![]() 对脱硫脱硝效率的影响分别如图所示,
对脱硫脱硝效率的影响分别如图所示,
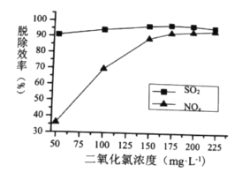
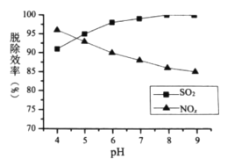
①最适宜的![]() 浓度为________
浓度为________![]() ;
;
②![]() 时,随着
时,随着![]() 的增大,
的增大,![]() 的脱除率下降,其可能的原因是__________
的脱除率下降,其可能的原因是__________
③![]() 时,
时,![]() 会发生歧化反应:
会发生歧化反应:![]() ,当有
,当有![]() 完全反应时,转移电子数目为________
完全反应时,转移电子数目为________![]() ;歧化反应生成的
;歧化反应生成的![]() 也可以作为氧化剂进行脱硝反应,写出碱性条件下
也可以作为氧化剂进行脱硝反应,写出碱性条件下![]() 将
将![]() 氧化为
氧化为![]() 的离子方程式______________。
的离子方程式______________。
(3)工业上以不锈钢材料为阴极,表面覆盖金属氧化物的石墨为阳极,电解![]() 溶液制备
溶液制备![]() 。写出阳极产生
。写出阳极产生![]() 的电极反应式________;此方法的缺点是所得产品纯度不高,
的电极反应式________;此方法的缺点是所得产品纯度不高,![]() 气体中所含的杂质可能有_____________。
气体中所含的杂质可能有_____________。
【答案】![]() 175
175 ![]() 增加,
增加,![]() 氧化性减弱,脱硝效率下降 0.1
氧化性减弱,脱硝效率下降 0.1 ![]()
![]()
![]()
【解析】
(1)根据盖斯定律计算反应热;
(2)根据![]() 的浓度、吸收液
的浓度、吸收液![]() 对脱硫脱硝效率的影响图像分析解答;
对脱硫脱硝效率的影响图像分析解答;
③根据电子转移计算;根据得失电子守恒、电荷守恒、元素守恒配平该离子方程式;
(3)根据电解原理分析解答。
(1)已知热化学方程式:①![]()
![]() ;
;
②![]()
![]() ;
;
③![]()
![]() ;
;
根据盖斯定律可知,由①+![]() ②+
②+![]() ③可得目标方程式,则反应
③可得目标方程式,则反应![]() 的
的![]()
![]()
![]() ;
;
(2)①由图可知,![]() 的浓度为175
的浓度为175![]() 时,脱硫效率最高,而高于175
时,脱硫效率最高,而高于175![]() 时,脱硝效率增大不明显,故最适宜的
时,脱硝效率增大不明显,故最适宜的![]() 浓度为175
浓度为175![]() ;
;
②![]() 时,随着
时,随着![]() 的增大,
的增大,![]() 的脱除率下降,其可能的原因是
的脱除率下降,其可能的原因是![]() 增加,
增加,![]() 氧化性减弱,脱硝效率下降;
氧化性减弱,脱硝效率下降;
③![]() 时,
时,![]() 会发生歧化反应:
会发生歧化反应:![]() ,该反应中,+4价的Cl,既有化合价升高到+5价,又有化合价降低到+3价,故有2mol
,该反应中,+4价的Cl,既有化合价升高到+5价,又有化合价降低到+3价,故有2mol![]() 参加反应时,转移1mol电子,则当有
参加反应时,转移1mol电子,则当有![]() 完全反应时,转移电子数目为0.1
完全反应时,转移电子数目为0.1![]() ;
;![]() 在碱性条件下可以将
在碱性条件下可以将![]() 氧化为
氧化为![]() ,根据得失电子守恒、电荷守恒、元素守恒配平该离子方程式为
,根据得失电子守恒、电荷守恒、元素守恒配平该离子方程式为![]() ;
;
(3)电解池中阳极发生氧化反应,电解![]() 溶液制备
溶液制备![]() 时,Cl元素由-1价升高为+4价,则该过程应在阳极发生,则阳极产生
时,Cl元素由-1价升高为+4价,则该过程应在阳极发生,则阳极产生![]() 的电极反应式为
的电极反应式为![]() ;阳极也可能发生反应
;阳极也可能发生反应![]() ,故此方法的缺点是所得产品纯度不高,
,故此方法的缺点是所得产品纯度不高,![]() 气体中所含的杂质可能有
气体中所含的杂质可能有![]() 。
。

【题目】结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 |
HClO | 3×10-8 |
H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
H2C2O4 | K1=5.4×10-2 K2=5.4×10-5 |
H2S | K1=1.3×10-7 K2=7.1×10-15 |
请回答下列问题:
(1)同浓度的CH3COO-、![]() 、
、![]() 、
、![]() 、ClO-、S2-中结合H+的能力最弱的是_____________。
、ClO-、S2-中结合H+的能力最弱的是_____________。
(2)常温下0.1molL-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_____________(填字母)。
A.c(H+) B.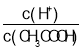 C.
C.![]() D.c(OH-)
D.c(OH-)
(3)pH相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是CH3COOK_____________NaClO,两溶液中:c(Na+)-c(ClO)_____________c(K+)-c(CH3COO-)(填“>”“<”或“=”)。
(4)向0.1molL-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5∶9,此时溶液pH=_____________。