题目内容
20.某市拟投资建设一个工业酒精厂,目的是用工业酒精与汽油混合制成“乙醇汽油”,以节省石油资源.已知制酒精的方法有三种:①CH2═CH2+H2O $→_{△}^{催化剂}$CH3CH2OH
②CH3CH2Br+H2O$→_{△}^{NaOH}$CH3CH2OH+HBr
③(C6H10O5)n(淀粉)+nH2O $\stackrel{淀粉酶}{→}$ nC6H12O6(葡萄糖);
C6H12O6(葡萄糖)$\stackrel{酒化酶}{→}$2C2H5OH+2CO2↑
从绿色化学(“原子利用率”最大化)的角度看,制酒精最好的方法是( )
| A. | ① | B. | ③ | C. | ①③ | D. | ①②③ |
分析 反应物全部转化为期望的产物,使原子的利用率达到100%,可知化合反应、加成反应、加聚反应达到绿色化学的要求.
解答 解:①CH2=CH2与H2O反应制取CH3CH2OH,为加成反应,原料利用率为100%,故①正确;
②CH3CH2Br与H2O反应制取CH3CH2OH为取代反应,有副产品HBr生成,不符合题中要求,故②错误;
③C6H12O6(葡萄糖)分解生成C2H5OH,有副产品CO2生成,不符合题中要求,故③错误;
故选A.
点评 本题考查“绿色化学”,难度不大,注意掌握绿色化学的概念及判断方法,正确理解题干要求为解答本题的关键.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案
相关题目
20.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使pH试纸显深蓝色的溶液:Na+、K+、I-、NO${\;}_{3}^{-}$ | |
| B. | 0.1mol•L-1的Ca(ClO)2溶液:K+、Na+、I-、Cl- | |
| C. | 能使甲基橙显红色的溶液:K+、Fe2+、Cl-、NO${\;}_{3}^{-}$ | |
| D. | 加KSCN显红色的溶液:Na+、Mg2+、I-、SO${\;}_{4}^{2-}$ |
15.在一定条件下,不是可逆反应A(g)+3B(g)?2C(g)达到平衡标志的为( )
| A. | C生成速率与C分解速率相等 | B. | A、B、C的浓度不再变化 | ||
| C. | A、B、C的物质的量之比为1:3:2 | D. | 体系压强不再变化 |
5.下列各组既不是同系物,又不是同分异构体的是( )
| A. | 乙烯和2-丁烯 | B. | 苯和乙炔 | ||
| C. | 1-氯丙烷和2-氯丙烷 | D. | 异丁烷和正戊烷 |
12.两种气态烃混合气体共1L,在空气中完全燃烧得到1.5L CO2和2L水蒸气(气体体积均在150℃条件下测定),关于此混合气体的判断合理的是( )
| A. | 一定含有甲烷 | B. | 一定含有乙烯 | ||
| C. | 可能是乙烷和甲烷的混合气体 | D. | 一定含有乙烯,不一定含有甲烷 |
9.下列各组离子在给定条件下能大量共存的是( )
| A. | 在c(H+)=1.0×10-13 mol•L-1的溶液中:Na+、S2-、AlO2-、SO32- | |
| B. | pH<7的溶液中:SO42-、CO32-、Na+、K+ | |
| C. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| D. | 在pH=1的溶液中:NH4+、K+、ClO-、Cl- |
10.下列关于物质的性质或用途的说法正确的是( )
| A. | 乙烯可使溴的四氯化碳溶液褪色 | B. | 乙醇难溶于水,密度比水小 | ||
| C. | 氧化镁用于电解冶炼单质镁 | D. | 二氧化硅用于制造太阳能电池 |
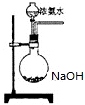 氨在国民经济中占有重要地位.
氨在国民经济中占有重要地位.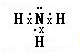 .
.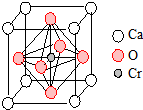 重铬酸钾(K2Cr2O7)是一种重要的氧化剂,可以检验司机是否酒后驾驶.
重铬酸钾(K2Cr2O7)是一种重要的氧化剂,可以检验司机是否酒后驾驶.