题目内容
NH3、H2O、HF熔沸点高低顺序为:H2O>HF>NH3.下列有关解释你认为合理的是( )
①H2O分子间比HF分子间更易形成氢键.
②HF分子间比NH3分子间更易形成氢键.
③等物质的量的H2O和HF中分子间形成的氢键数H2O中比HF中多.
④H2O分子内O-H键能大,HF分子内H-F键能小.
⑤水分子的极性最强,NH3分子的极性最弱.
①H2O分子间比HF分子间更易形成氢键.
②HF分子间比NH3分子间更易形成氢键.
③等物质的量的H2O和HF中分子间形成的氢键数H2O中比HF中多.
④H2O分子内O-H键能大,HF分子内H-F键能小.
⑤水分子的极性最强,NH3分子的极性最弱.
| A、①② | B、②③ | C、①③④ | D、③⑤ |
考点:含有氢键的物质,键能、键长、键角及其应用,极性键和非极性键
专题:化学键与晶体结构
分析:①电负性:F>O>N,故HF分子间比H2O分子间更易形成氢键;
②电负性:F>O>N,故HF分子间比NH3分子间更易形成氢键;
③等物质的量的H2O和HF中分子间形成的氢键数H2O中比HF中多;
④HF分子内H-F键能大于H2O分子内O-H键能大,故HF比水稳定,与熔沸点无关;
⑤水分子和NH3分子的极性都很强,与熔沸点无关.
②电负性:F>O>N,故HF分子间比NH3分子间更易形成氢键;
③等物质的量的H2O和HF中分子间形成的氢键数H2O中比HF中多;
④HF分子内H-F键能大于H2O分子内O-H键能大,故HF比水稳定,与熔沸点无关;
⑤水分子和NH3分子的极性都很强,与熔沸点无关.
解答:
解:①电负性:F>O>N,故HF分子间比H2O分子间更易形成氢键,故①不选;
②电负性:F>O>N,故HF分子间比NH3分子间更易形成氢键,故②可选;
③等物质的量的H2O和HF中分子间形成的氢键数H2O中比HF中多,故③可选;
④HF分子内H-F键能大于H2O分子内O-H键能大,故HF比水稳定,与熔沸点无关,故④不选;
⑤水分子和NH3分子的极性都很强,与熔沸点无关,故⑤不选;
故合理的是②③,
故选B.
②电负性:F>O>N,故HF分子间比NH3分子间更易形成氢键,故②可选;
③等物质的量的H2O和HF中分子间形成的氢键数H2O中比HF中多,故③可选;
④HF分子内H-F键能大于H2O分子内O-H键能大,故HF比水稳定,与熔沸点无关,故④不选;
⑤水分子和NH3分子的极性都很强,与熔沸点无关,故⑤不选;
故合理的是②③,
故选B.
点评:本题考查氢键的形成条件及对物质熔沸点的影响,难度不大.要注意氢键只影响物质的物理性质.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
下列微粒:①H3O+②NH4+③CH3COO-④NH3⑤CH4中含有配位键的是( )
| A、①② | B、①③ | C、④⑤ | D、②④ |
在1L1mol/L的氨水中( )
| A、含有1molNH3 |
| B、含NH3和NH4+之和为1mol |
| C、含NH3?H2O1mol |
| D、含NH3、NH4+、NH3?H2O共1mol |
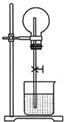 如图为中学化学教材上的喷泉实验装置.在烧瓶中充满了干燥气体,胶头滴管及烧瓶中分别盛有液体,下列各组中能形成这样喷泉但液体不能充满烧瓶的是( )
如图为中学化学教材上的喷泉实验装置.在烧瓶中充满了干燥气体,胶头滴管及烧瓶中分别盛有液体,下列各组中能形成这样喷泉但液体不能充满烧瓶的是( )| A、NH3 |
| B、NO2和H2O |
| C、CO2和NaOH溶液 |
| D、4:1的NO2与O2和水 |
取等质量的有机物A两份,一份与足量的金属钠反应,收集到的气体体积为V1 L;另一份与足量的小苏打溶液反应,收集到的气体体积为V2 L,在相同条件下,2V1=V2,则A的结构简式可能是( )
| A、HOCH2CH2COOH |
| B、HOOC-CH2CH(OH)CH2COOH |
| C、HOOC-COOH |
| D、HOCH2CH2CH2OH |
下列说法中,正确的是( )
| A、22.4L的HCl含有6.02×1023个粒子 |
| B、32g氧气中含有2mol的氧原子 |
| C、氢氧化钠的摩尔质量为40g |
| D、如果有6.02×1023颗大米,则这些大米的物质的量为1mol |
在2NO2?N2O4的可逆反应中,下列状态一定属于平衡状态的是( )
| A、N2O4和NO2的分子数比为1:2 |
| B、N2O4和NO2的浓度相等 |
| C、平衡体系的颜色一定不再改变 |
| D、单位时间有1 mol N2O4变为NO2的同时,有2 mol NO2变为N2O4 |
生物学家借助新的显微技术,成功观察到小于20nm的微粒.下列分散系中分散质粒子直径最小的是 (1nm=1x10-9m)( )
| A、雾 |
| B、氢氧化铁胶体 |
| C、石灰乳 |
| D、KNO3溶液 |