题目内容
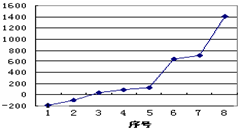 (1)第三周期8种元素按单质熔点高低的顺序
(1)第三周期8种元素按单质熔点高低的顺序如右图,其中序号“8”代表
(2)请写出比元素1的原子序数小8的元素的基态原子电子轨道式
(3)元素7的单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示.
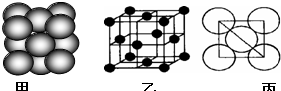
若已知7的原子半径为d,NA代表阿伏加德罗常数,7的相对原子质量为M,请回答:
①晶胞中7原子的配位数为
②该晶体的密度为
考点:晶胞的计算,位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:(1)第3周期8种元素中Si是原子晶体,单质的熔点最高;同周期自左而右电负性增强,Cl元素电负性最强,第三周期中其沸点仅高于氩;
(2)1的沸点最低,应为Ar,原子序数小8则为Ne;
(3)①由图可知,晶胞为面心立方堆积,以顶点的原子分析,位于面心的原子与之相邻,1个顶点原子为12个面共用;根据均摊法计算晶胞中含有原子数目;
②由图丙可知,正方形对角线长度为4d cm,故立方体的棱长为
×4dcm=2
d cm,晶胞体积为(2
dcm)3=16
d3cm3,根据晶胞含有原子数目计算晶胞的质量,再根据ρ=
计算密度.
(2)1的沸点最低,应为Ar,原子序数小8则为Ne;
(3)①由图可知,晶胞为面心立方堆积,以顶点的原子分析,位于面心的原子与之相邻,1个顶点原子为12个面共用;根据均摊法计算晶胞中含有原子数目;
②由图丙可知,正方形对角线长度为4d cm,故立方体的棱长为
| ||
| 2 |
| 2 |
| 2 |
| 2 |
| m |
| V |
解答:
(1)第3周期8种元素中Si是原子晶体,单质的熔点最高;同周期自左而右电负性增强(稀有气体除外),故Cl元素的电负性最强,第三周期中其沸点仅高于氩,故为序号2,
故答案为:Si;2;
(2)1的沸点最低,应为Ar,原子序数小8则为Ne,其核外电子排布式为1s22s22p6,
故答案为:1s22s22p6;
(3)①由图可知,晶胞为面心立方堆积,以顶点的原子分析,位于面心的原子与之相邻,1个顶点原子为12个面共用,故配位数为12;晶胞中含有原子数目=8×
+6×
=4,
故答案为:12;4;
②由图丙可知,正方形对角线长度为4d cm,故立方体的棱长为
×4dcm=2
d cm,晶胞体积为(2
dcm)3=16
d3cm3,晶胞中含有原子数目=8×
+6×
=4,
相对原子质量为M,故晶胞的质量=4×
g,故晶体的密度=
g/cm3=
g/cm3,
故答案为:
.
故答案为:Si;2;
(2)1的沸点最低,应为Ar,原子序数小8则为Ne,其核外电子排布式为1s22s22p6,
故答案为:1s22s22p6;
(3)①由图可知,晶胞为面心立方堆积,以顶点的原子分析,位于面心的原子与之相邻,1个顶点原子为12个面共用,故配位数为12;晶胞中含有原子数目=8×
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:12;4;
②由图丙可知,正方形对角线长度为4d cm,故立方体的棱长为
| ||
| 2 |
| 2 |
| 2 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
相对原子质量为M,故晶胞的质量=4×
| M |
| NA |
| ||
16
|
| M | ||
4
|
故答案为:
| M | ||
4
|
点评:本题考查物质结构与性质、元素周期律、核外电子排布、晶胞结构与计算等,注意对电离能突变的理解,晶胞计算需要学生具有一定的数学计算能力与空间想象力,难度中等

练习册系列答案
相关题目
海藻中含有丰富的碘元素.下图是实验室从海藻里提取碘的流程的一部分.下列判断正确的是( )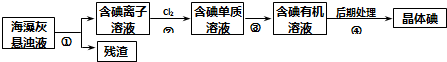

| A、步骤④的操作是过滤 |
| B、可用淀粉溶液检验步骤②的反应是否进行完全 |
| C、步骤①、③的操作分别是过滤、萃取 |
| D、步骤③中加入的有机溶剂可能是苯或CCl4 |
 针对如图所示乙醇分子结构,乙醇与金属钠反应时,
针对如图所示乙醇分子结构,乙醇与金属钠反应时,

 据以上线索和下列反应事实,
据以上线索和下列反应事实,

