题目内容
17.下列分子中所有原子都满足最外层为8电子结构的是( )| A. | BeCl2 | B. | CH4 | C. | SiCl4 | D. | PCl5 |
分析 对ABn型分子,A的族序数+成键数=8,则满足所有原子都满足最外层8电子结构,含有H元素的化合物中H元素一定不满足8电子结构.
解答 解:A.BeCl2中,Be原子的最外层电子为:2+2=4,Cl原子的最外层电子为:7+|-1|=8,不都满足8电子稳定结构,故A错误;
B.CH4分子中H原子最外层满足2电子结构,故B错误;
C.SiCl4中,Si元素位于IVA族,4+4=8,所以所有原子都满足最外层为8电子结构,故C正确;
D.PCl5中,P原子的最外层电子为:5+5=10,Cl原子的最外层电子为:7+|-1|=8,不都满足8电子稳定结构,故D错误;
故选C.
点评 本题考查原子的结构,本题中注意判断是否满足8电子结构的方法,注意利用化合价与最外层电子数来分析即可解答,明确所有原子都满足最外层8电子结构是解答的关键.

练习册系列答案
相关题目
7.NA表示阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA | |
| B. | 1 mol NO2和CO2的混合气体中含有的氧原子数为NA | |
| C. | 1.7g H2O2中含有的电子数为0.9NA | |
| D. | 1 mol Al3+离子含有的核外电子数为3NA |
8. 用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)从实验装置上看,明显存在的一处错误是:小烧杯口和大烧杯口没有平齐,图中尚缺少的一种玻璃仪器是:环形玻璃搅拌棒;
(2)烧杯间填满碎纸条的作用是减少实验过程中的热量损失;
(3)大烧杯上如不盖硬纸板,求得的中和热数值偏小(填“偏大、偏小、无影响”);
(4)改正实验装置后,某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热△H=-55.2kJ/mol;(保留三位有效数字)
(5)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量多(填“多”、“少”或“相等”,下同),所求中和热相等.
 用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)从实验装置上看,明显存在的一处错误是:小烧杯口和大烧杯口没有平齐,图中尚缺少的一种玻璃仪器是:环形玻璃搅拌棒;
(2)烧杯间填满碎纸条的作用是减少实验过程中的热量损失;
(3)大烧杯上如不盖硬纸板,求得的中和热数值偏小(填“偏大、偏小、无影响”);
(4)改正实验装置后,某学生实验记录数据如下:
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.4 |
| 2 | 20.2 | 20.4 | 23.6 |
| 3 | 20.5 | 20.6 | 23.8 |
(5)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量多(填“多”、“少”或“相等”,下同),所求中和热相等.
5.若向某溶液中加入适量的溴水,溶液仍呈无色,则该溶液中可能含有的离子是( )
| A. | Cu2+ | B. | I- | C. | SO32- | D. | Fe2+ |
12.下列说法中错误的是( )
| A. | 根据对角线规则,铍和铝的性质具有相似性 | |
| B. | 在H3O+、NH4+ 和[Cu(NH3)4]2+中都存在配位键 | |
| C. | P4和CH4都是正四面体分子且键角都为109°28ˊ | |
| D. | 元素电负性越大的原子,吸引电子的能力越强 |
2.在120℃、101kPa时,将1L丁烷和若干升O2混合,点燃使之充分反应.反应后,恢复到原温度和原压强,测得的气体体积为mL,若通过足量碱石灰,气体体积变为nL.若m-n=8,则反应消耗掉的O2体积是(同温同压)( )
| A. | 5L | B. | 5.5L | C. | 6L | D. | 6.5L |
9.已知:2X+Y?2Z,反应中ω(Z的物质的量分数)随温度T的变化如下图所示.下列判断正确的是( ) 

| A. | T 1时,v正>v逆 | |
| B. | 正反应的△H<0 | |
| C. | a、b两点的反应速率 v( a)=v( b) | |
| D. | T<T 1时,ω增大的原因是平衡向正方向移动 |




 )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下: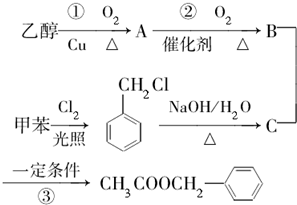
 .
. .
.