题目内容
9.已知:2X+Y?2Z,反应中ω(Z的物质的量分数)随温度T的变化如下图所示.下列判断正确的是( )
| A. | T 1时,v正>v逆 | |
| B. | 正反应的△H<0 | |
| C. | a、b两点的反应速率 v( a)=v( b) | |
| D. | T<T 1时,ω增大的原因是平衡向正方向移动 |
分析 当可逆反应达到化学平衡状态时,反应物的转化率最大,产物的产率也最高,由此可以判断0-T1阶段是化学平衡的建立过程,以后是温度对化学平衡的影响情况,根据化学平衡的建立过程以及温度对化学平衡的影响知识来解决.
解答 解:当可逆反应达到化学平衡状态时,产物Z的生成率最大,物质的量分数最大,所以T1时刻,化学反应达到了平衡状态.
A、T1时,化学反应达到了平衡状态,v正=v逆,故A错误;
B、当温度高于T1时,Z的物质的量分数逐渐减小,所以化学平衡逆向移动,即逆反应方向是吸热的,所以正反应是一个放热反应,即△H<0,故B正确;
C、温度越高,化学反应速率越大,b点温度高于a点,所以b的速率高于a点的速率,即va<vb,故C错误;
D、0-T1阶段是化学平衡的建立过程,反应开始向右不断进行,生成的Z的量越来越大,所以ω增大,故D错误.
故选B.
点评 本题考查学生化学平衡的建立、化学平衡状态的特征以及化学平衡受温度的影响等方面的知识,属于综合知识的考查,难度不大.

练习册系列答案
相关题目
19.2.0mol PCl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)?PCl5(g)达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
| A. | 0.40 mol | B. | 0.20 mol | ||
| C. | 小于0.20 mol | D. | 大于0.20 mol,小于0.40 mol |
20.下列有机物的命名中,正确的是( )
| A. | 2,4-二甲基丁烷 | B. | 2,3,3-三甲基丁烷 | ||
| C. | 2-乙基-1-戊烯 | D. | 2,2,3-三甲基-1-戊烯 |
17.下列分子中所有原子都满足最外层为8电子结构的是( )
| A. | BeCl2 | B. | CH4 | C. | SiCl4 | D. | PCl5 |
4.金属钛对人体体液无毒且有惰性,能与肌肉和骨骼生成在一起,故有“生命金属”之称.下列有关4822Ti和5022Ti的说法正确的是( )
| A. | 质量数相同,互为同位素 | |
| B. | 质子数相同,互为同位素 | |
| C. | 中子数相同,属同一种元素的不同核素 | |
| D. | 核外电子数相同,中子数不同,不能互称为同位素 |
18.有机物M的结构简式如图所示,有关M的说法错误的是( )
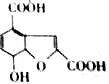

| A. | M的分子式为C18H8O8 | |
| B. | 1molM最多可与3molNa反应 | |
| C. | 一个M分子中含有一个苯环和两个羧基 | |
| D. | M可发生酯化反应,氧化反应 |
19.下列物质与苯互为同系物的是( )
| A. |  | B. |  | C. |  | D. |  |
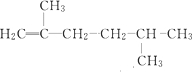 ;
;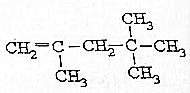
 ;
; →
→ .
.