题目内容
已知热化学方程式:SO2(g)+
O2(g)?SO3(g);△H=-98.32kJ/mol,温度相同时,分别向恒容容器和恒压容器中充入1molSO2和0.5molO2充分反应,达平衡后,放出热量分别为:Q1kJ、Q2kJ,则下列关系正确的是( )
| 1 |
| 2 |
| A、Q1=Q2=98.32 |
| B、Q1>Q2>98.32 |
| C、Q2<Q1<98.32 |
| D、Q1<Q2<98.32 |
考点:有关反应热的计算
专题:化学反应中的能量变化
分析:反应是可逆的,根据热化学方程式的含义,当恒容容器中充入1molSO2和0.5molO2充分反应,则放出的热量会小于98.32kJ,如果保持恒压,由于反应后气体物质的量减小,所以压强会减小,恒压相当于在恒容的基础上增大压强,增大压强,平衡会正向移动,据此回答判断.
解答:
解:热化学方程式:SO2(g)+
O2(g)?SO3(g);△H=-98.32kJ/mol表示1mol二氧化硫和0.5mol氧气完全反应生成三氧化硫会放出98.32kJ的热量,但是反应是可逆的,当向恒容容器中充入1molSO2和0.5molO2充分反应,则放出的热量会小于98.32kJ,即Q1<98.32kJ,如果保持恒压,由于反应后气体物质的量减小,所以压强会减小,在恒压下进行该反应,相当于在恒容的基础上增大压强,平衡会正向移动,所以放出的热量比恒容时的热量要多,即Q1<Q2,但是反应物仍然不会完全反应,放出的热量Q2仍然是小于98.32kJ的.
故选D.
| 1 |
| 2 |
故选D.
点评:本题考查反应热的计算,题目难度中等,本题注意压强对平衡的影响以及可逆反应的特征是关键.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
下列叙述错误的是( )
①热稳定性:H2O>HF>H2S
②熔点:Al>Na>K
③ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤多电子原子中,在离核较近的区域内运动的电子能量较高
⑥盐酸可以碳酸钠溶液反应生成CO2气体,说明盐酸比碳酸强,Cl 比S的非金属性强
⑦SiCl4、PCl3分子中各原子最外层均达到8电子稳定结构.
①热稳定性:H2O>HF>H2S
②熔点:Al>Na>K
③ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤多电子原子中,在离核较近的区域内运动的电子能量较高
⑥盐酸可以碳酸钠溶液反应生成CO2气体,说明盐酸比碳酸强,Cl 比S的非金属性强
⑦SiCl4、PCl3分子中各原子最外层均达到8电子稳定结构.
| A、①③⑤⑥ | B、②④⑥ |
| C、②③④⑦ | D、①⑤⑥ |
下列溶液中的C1-的物质的量浓度与150.0mL l.0mol/L CaCl2溶液中的Cl-物质的量浓度相等的是( )
| A、150.0mL 1.0 mol/L NaCl溶液 |
| B、75.0mL 2.0 mol/L MgCl2溶液 |
| C、150.0mL 2.0 mol/LKCl溶液 |
| D、75.0 mL 1.0 mol/L A1C13溶液 |
下列各式中,属于水解方程式的是( )
| A、HCO3-+OH-=H2O+CO32- |
| B、NH3+H+=NH4+ |
| C、NH3?H2O?NH4++OH- |
| D、HCO3-+H2O?H2CO3+OH- |
只用下列一种试剂就可以将六种无色液体:C2H5OH、AgNO3溶液、C2H5Br、苯酚溶液、己烯、苯鉴别开来的是( )
| A、FeCl2溶液 |
| B、溴水 |
| C、酸性高锰酸钾溶液 |
| D、NaOH溶液 |
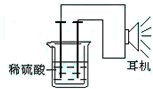 利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池.请填写下列空白:
利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池.请填写下列空白: