题目内容
10.三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:①写出该反应的化学方程式3NF3+5H2O=2NO+HNO3+9HF,反应中生成0.1mol HNO3,转移的电子数目为0.2NA.
②NF3无色、无臭,但一旦在空气中泄漏,还是易于发现,判断该气体泄漏时的现象是泄漏处出现红棕色气体.
分析 由反应物和生成物可写出反应的化学方程式为3NF3+5H2O=2NO+HNO3+9HF,反应中只有N元素的化合价发生变化,NO易与空气中氧气反应生成红棕色的NO2气体,根据硝酸和转移电子之间的关系式计算;据此分析.
解答 解:①NF3→NO,化合价降低1价,被还原,NF3→HNO3,化合价升高2价,被氧化,由反应物和生成物可写出反应的化学方程式为3NF3+5H2O=2NO+HNO3+9HF,
该反应中3NF3+5H2O=9HF+2NO+HNO3中,生成1molHNO3和转移电子2mol,所以若反应中生成0.1mol HNO3,转移的电子数目=0.1mol×2×NA/mol=0.2NA;
故答案为:3NF3+5H2O=2NO+HNO3+9HF;0.2NA;
②反应中生成NO,NO易与空气中氧气反应生成红棕色的NO2气体;
故答案为:泄漏处出现红棕色气体.
点评 本题考查含氮化合物的性质以及氧化还原反应,题目难度不大,注意从化合价变化的角度分析氧化还原反应的有关概念和计算,注意把握题给信息,为解答该题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.为了探究原电池的电极名称不仅与电极材料有关还与电解质溶液有关,某学生做了如下的实验
根据以上表格内容回答:
(1)实验①中Mg作负极(填“正极”或“负极”),发生氧化反应(填“氧化反应”或“还原反应”).实验③中Mg作正极(填“正极”或“负极”),总反应的离子方程式为:2Al+2OH-+2H2O=AlO2-+3H2↑.
(2)实验②中Al电极上的电极反应式为2H++2e-═H2↑;.
(3)实验④中正极的电极反应式为NO3-+3e-+4H+=NO↑+2H2O.这样构成的原电池与常见的原电池不同,原因是铝在浓硝酸中发生了钝化.
| 编号 | 电极材料 | 电解质溶液 | 电子流向 |
| ① | Mg-Al | HNO3(浓) | Mg→Al |
| ② | Mg-Al | HCl(aq) | Mg→Al |
| ③ | Mg-Al | NaOH(aq) | Al→Mg |
| ④ | Al-Cu | HNO3(浓) | Cu→Al |
(1)实验①中Mg作负极(填“正极”或“负极”),发生氧化反应(填“氧化反应”或“还原反应”).实验③中Mg作正极(填“正极”或“负极”),总反应的离子方程式为:2Al+2OH-+2H2O=AlO2-+3H2↑.
(2)实验②中Al电极上的电极反应式为2H++2e-═H2↑;.
(3)实验④中正极的电极反应式为NO3-+3e-+4H+=NO↑+2H2O.这样构成的原电池与常见的原电池不同,原因是铝在浓硝酸中发生了钝化.
1.以下是元素周期表的一部分,回答下列有关问题:
(1)与水反应最剧烈的金属元素是K;元素构成的最稳定气态氢化物的化学式是HF;③、④、⑧元素原子半径由大到小是Si>N>O(用元素符号作答).
(2)表中⑦元素形成的两性氢氧化物化学式是Al(OH)3,写出该元素的单质与⑥最高 价氧化物的水化物反应的离子方程式2Al+2H2O+2OH-=2AlO2-+3H2↑.
(3)②、④两种元素形成某气体化合物是导致温室效应的主要原因,该化合物的电子式为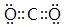 ;元素⑥可形成一种碱性氧化物,用电子式表示该碱性氧化物的形成过程
;元素⑥可形成一种碱性氧化物,用电子式表示该碱性氧化物的形成过程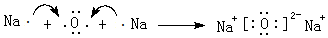 .
.
(4)②的单质与③的最高价氧化物的水化物的浓溶液反应化学方程式C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ⑤ | |||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
| 4 | ⑪ | ⑫ |
(2)表中⑦元素形成的两性氢氧化物化学式是Al(OH)3,写出该元素的单质与⑥最高 价氧化物的水化物反应的离子方程式2Al+2H2O+2OH-=2AlO2-+3H2↑.
(3)②、④两种元素形成某气体化合物是导致温室效应的主要原因,该化合物的电子式为
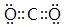 ;元素⑥可形成一种碱性氧化物,用电子式表示该碱性氧化物的形成过程
;元素⑥可形成一种碱性氧化物,用电子式表示该碱性氧化物的形成过程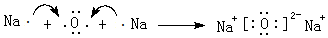 .
.(4)②的单质与③的最高价氧化物的水化物的浓溶液反应化学方程式C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
18.下列说法中正确的是( )
| A. | 测定溶液的pH值,应先将pH试纸用蒸馏水润湿 | |
| B. | 称量加热后的固体时,均需先将固体在空气中冷却后再称量 | |
| C. | 配制0.1mol/LNa2CO3溶液时,容量瓶应先用0.1mol/L Na2CO3润洗 | |
| D. | 除去铁粉中混有的少量铝粉,可加人过量的氢氧化钠溶液,完全反应后过滤、干燥 |
15.下列推断正确的是( )


| A. | 甲可能为硝酸银 | B. | 乙可能为氯气 | ||
| C. | 丙可能为镁 | D. | 甲可能为氢氧化钠 |
2.下列对4g氦气的说法正确的是( )
| A. | 标准状况下的体积为11.2L | B. | 含NA个氦气分子 | ||
| C. | 含NA个电子 | D. | 物质的量为0.5mol |
20.下列离子或分子组中大量共存且满足相应要求的是( )
| A. | K+、AlO2-、Cl-、MnO4- 要求:无色澄清溶液 | |
| B. | Fe3+、NO3-、I-、HCO3- 要求:逐滴滴加盐酸立即产生气体 | |
| C. | Na+、K+、Ag+,NO3- 要求:逐滴滴加氨水先有沉淀产生,后沉淀消失 | |
| D. | NH4+、Al3+、SO42-、CH3COOH 要求:滴加NaOH浓溶液立刻产生气体 |
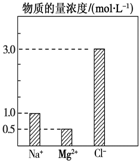 在0.2L由NaCl、MgCl2、BaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
在0.2L由NaCl、MgCl2、BaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
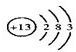 ; F的化学式FeCl2.
; F的化学式FeCl2.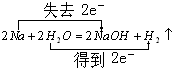 .反应②:
.反应②: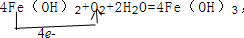 .
.