题目内容
某同学用密度为1.84g/cm3、质量分数为98%的浓硫酸配制500mL0.22mol/L的稀硫酸.
(1)操作过程中使用到的玻璃仪器有 .
(2)实验过程中涉及的操作如下:
①将容量瓶中的溶液倒入试剂瓶中并贴上标签;
②将浓硫酸沿烧杯内壁缓慢注入盛有约160mL蒸馏水的烧杯中并小心搅拌;
③用规格为 mL的量筒量取 mL的浓硫酸;
④将已冷却的硫酸溶液沿玻璃棒小心注入容量瓶中,并用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液都注入容量瓶中,轻轻摇动容量瓶,使溶液混合均匀;
⑤改用胶头滴管滴加蒸馏水,使溶液凹液面最低处恰好与刻度线相切;
⑥塞好玻璃塞,反复颠倒摇匀;
⑦继续向容量瓶中加蒸馏水直到距离刻度线 cm处;
实验操作顺序为 (填序号).
(3)配制该溶液的过程中,下列操作使得所配得的溶液浓度偏小的是 (填字母).
A.稀释密度为1.84g/cm3、质量分数为98%的浓硫酸时,不小心溅出少量硫酸溶液.
B.配制该稀硫酸溶液时,未将洗涤烧杯及玻璃棒的溶液注入容量瓶中.
C.容量瓶里所配的溶液的液面未到刻度线便停止了加水.
D.量取密度为1.84g/cm3、质量分数为98%的浓硫酸时,仰视量筒的刻度线.
E.洗涤容量瓶后,立即用来配制溶液.
(1)操作过程中使用到的玻璃仪器有
(2)实验过程中涉及的操作如下:
①将容量瓶中的溶液倒入试剂瓶中并贴上标签;
②将浓硫酸沿烧杯内壁缓慢注入盛有约160mL蒸馏水的烧杯中并小心搅拌;
③用规格为
④将已冷却的硫酸溶液沿玻璃棒小心注入容量瓶中,并用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液都注入容量瓶中,轻轻摇动容量瓶,使溶液混合均匀;
⑤改用胶头滴管滴加蒸馏水,使溶液凹液面最低处恰好与刻度线相切;
⑥塞好玻璃塞,反复颠倒摇匀;
⑦继续向容量瓶中加蒸馏水直到距离刻度线
实验操作顺序为
(3)配制该溶液的过程中,下列操作使得所配得的溶液浓度偏小的是
A.稀释密度为1.84g/cm3、质量分数为98%的浓硫酸时,不小心溅出少量硫酸溶液.
B.配制该稀硫酸溶液时,未将洗涤烧杯及玻璃棒的溶液注入容量瓶中.
C.容量瓶里所配的溶液的液面未到刻度线便停止了加水.
D.量取密度为1.84g/cm3、质量分数为98%的浓硫酸时,仰视量筒的刻度线.
E.洗涤容量瓶后,立即用来配制溶液.
考点:配制一定物质的量浓度的溶液
专题:实验题
分析:(1)依据配制一定物质的量浓度溶液的步骤选择仪器;
(2)③依据C=
计算浓硫酸的物质的量浓度,依据稀释前后溶液含溶质的物质的量不变计算需要浓硫酸的体积,依次选择合适的量筒;
⑦依据定容过程的正确操作解答;
依据配制一定物质的量浓度溶液的步骤排列实验操作正确顺序;
(3)依据C=
进行误差分析,分析不当操作对溶质的物质的量和溶液的体积的影响.
(2)③依据C=
| 1000ρω |
| M |
⑦依据定容过程的正确操作解答;
依据配制一定物质的量浓度溶液的步骤排列实验操作正确顺序;
(3)依据C=
| n |
| V |
解答:
解:(1)配制一定物质的量浓度溶液的步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等,用到的仪器有:量筒、玻璃棒、烧杯、500mL容器瓶、胶头滴管;
故答案为:量筒、玻璃棒、烧杯、500mL容器瓶、胶头滴管;
(2)③密度为1.84g/cm3、质量分数为98%的浓硫酸的物质的量浓度C=
=18.4mol/L,稀释前后溶液含溶质的物质的量不变,设需要浓硫酸体积为V,则V×18.4mol/L=500mL×0.22mol/L
解得V=6.0ml,所以应选择10ml量筒;
故答案为:10;6.0;
⑦定容时,开始继续向容量瓶中加蒸馏水直到距离刻度线1-2cm,改用胶头滴管逐滴滴加到凹液面最低处与刻度线相切;
故答案为:1~2;
配制一定物质的量浓度溶液的步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀,所以正确的操作顺序为:③②④⑦⑤⑥①;
故答案为:③②④⑦⑤⑥①;
(3)A.稀释密度为1.84g/cm3、质量分数为98%的浓硫酸时,不小心溅出少量硫酸溶液,导致溶质的物质的量偏小,溶液的浓度偏小,故A正确;
B.配制该稀硫酸溶液时,未将洗涤烧杯及玻璃棒的溶液注入容量瓶中,导致溶质的物质的量偏小,溶液的浓度偏小,故B正确;
C.容量瓶里所配的溶液的液面未到刻度线便停止了加水,导致溶液的体积偏小,溶液的浓度偏大,故C错误;
D.量取密度为1.84g/cm3、质量分数为98%的浓硫酸时,仰视量筒的刻度线,导致量取的浓硫酸体积偏大,溶质的物质的量偏大,溶液的浓度偏大,故D错误;
E.洗涤容量瓶后,立即用来配制溶液,对溶质的物质的量和溶液的体积都不会产生影响,溶液的浓度不变,故E错误;
故选:AB.
故答案为:量筒、玻璃棒、烧杯、500mL容器瓶、胶头滴管;
(2)③密度为1.84g/cm3、质量分数为98%的浓硫酸的物质的量浓度C=
| 1000×1.84g/L×98% |
| 98g/mol |
解得V=6.0ml,所以应选择10ml量筒;
故答案为:10;6.0;
⑦定容时,开始继续向容量瓶中加蒸馏水直到距离刻度线1-2cm,改用胶头滴管逐滴滴加到凹液面最低处与刻度线相切;
故答案为:1~2;
配制一定物质的量浓度溶液的步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀,所以正确的操作顺序为:③②④⑦⑤⑥①;
故答案为:③②④⑦⑤⑥①;
(3)A.稀释密度为1.84g/cm3、质量分数为98%的浓硫酸时,不小心溅出少量硫酸溶液,导致溶质的物质的量偏小,溶液的浓度偏小,故A正确;
B.配制该稀硫酸溶液时,未将洗涤烧杯及玻璃棒的溶液注入容量瓶中,导致溶质的物质的量偏小,溶液的浓度偏小,故B正确;
C.容量瓶里所配的溶液的液面未到刻度线便停止了加水,导致溶液的体积偏小,溶液的浓度偏大,故C错误;
D.量取密度为1.84g/cm3、质量分数为98%的浓硫酸时,仰视量筒的刻度线,导致量取的浓硫酸体积偏大,溶质的物质的量偏大,溶液的浓度偏大,故D错误;
E.洗涤容量瓶后,立即用来配制溶液,对溶质的物质的量和溶液的体积都不会产生影响,溶液的浓度不变,故E错误;
故选:AB.
点评:本题考查了一定物质的量浓度溶液的配置,题目难度不大,熟悉配置过程是解题关键,注意依据C=
进行误差分析的方法和技巧.
| n |
| V |

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1mol物质的含义是( )
| A、0.012 kg碳 |
| B、含有6.02×1023个粒子的物质 |
| C、含有阿伏加德罗常数个粒子的物质 |
| D、含有与6.02×1023个碳原子等质量的物质 |
铁、铜混合粉末18.0g加入到100mL 5.0mol?L-1 FeCl3溶液中,充分反应后,剩余固体质量为2.8g.下列说法正确的是( )
| A、剩余固体是铁、铜混合物 |
| B、原固体混合物中铜的质量是9.6g |
| C、反应后溶液中n(Fe3+)=0.10mol |
| D、反应后溶液中n(Fe2+)+n(Cu2+)=0.75mol |
试预测下列哪些物质不具备漂白性( )
| A、Na2O |
| B、Na2O2 |
| C、HClO |
| D、NaClO |
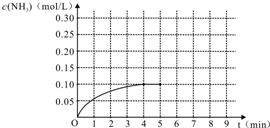 在容积为2L的密闭容器内加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)+Q(Q>0).反应中NH3的物质的量浓度随时间的变化情况如图:
在容积为2L的密闭容器内加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)+Q(Q>0).反应中NH3的物质的量浓度随时间的变化情况如图: