题目内容
16.设NA为阿伏加德罗常数,下列叙述正确的是( )| A. | 27 g铝原子最外层电子总数为NA | |
| B. | 2.8 g N2和2.8 g NO2所含电子数均为1.4NA | |
| C. | 1 L 0.1 mol•L-1乙酸溶液中H+数为0.1NA | |
| D. | 标准状况下,22.4 L甲烷的分子数NA |
分析 A、求出铝的物质的量,然后根据1mol铝原子的最外层有3mol电子来分析;
B、分别求出两者的物质的量,然后根据1mol氮气中含14mol电子,而1mol二氧化氮中含23mol电子来分析;
C、乙酸是弱酸;
D、分子数N=$\frac{V}{{V}_{m}}{N}_{A}$.
解答 解:A、27g铝的物质的量为1mol,而1mol铝原子的最外层有3mol电子即3NA个,故A错误;
B、2.8g氮气的物质的量为0.1mol,而1mol氮气中含14mol电子,故0.1mol氮气中含1.4mol电子即1.4NA个;而2.8g二氧化氮的物质的量为n=$\frac{2.8g}{46g/mol}$=0.06mol,而1mol二氧化氮中含23mol电子,故0.06mol二氧化氮中含1.39mol电子即1.39NA个,故B错误;
C、乙酸是弱酸,故不能完全电离,则溶液中的氢离子的个数小于0.1NA个,故C错误;
D、分子数N=$\frac{V}{{V}_{m}}{N}_{A}$=$\frac{22.4L}{22.4L/mol}{N}_{A}/mol$=NA,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
6.下列有机反应不属于取代反应的是( )
| A. | C2H5OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOC2H5+H2O | |
| B. | H-C≡C-H+HCl$\stackrel{催化剂}{→}$H2C=CHCl | |
| C. | 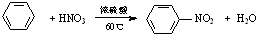 | |
| D. |  |
7.2015年8月12日晚11时许,天津市塘沽开发区一带发生爆炸事故,现场火光冲天.据多位市民反映,事发时十公里范围内均有震感,抬头可见蘑菇云,安全问题再次敲响了警钟.下列关于安全问题的说法不正确的是( )
| A. | 危险化学品包括:爆炸品、易燃物质、自燃自热物质、氧化性物质、剧毒物质、加压气体等 | |
| B. | 金属钠着火不能用水灭火,应使用干砂灭火 | |
| C. | 处置实验过程中产生的有毒药品废液时,应用大量水稀释后才能排入下水道 | |
| D. | 简单辨认有味的化学药品时,将瓶口远离鼻子,用手在瓶口上方扇动,稍闻其味即可 |
4.碘在不同状态下(固态或气态)与氢气反应的热化学方程式如下所示:
①H2(g)+I2(?)═2HI(g);△H=+9.48kJ/mol
②H2(g)+I2(?)═2HI(g);△H=-26.48kJ/mol
下列判断正确的是( )
①H2(g)+I2(?)═2HI(g);△H=+9.48kJ/mol
②H2(g)+I2(?)═2HI(g);△H=-26.48kJ/mol
下列判断正确的是( )
| A. | ①中的I2为固态,②中的I2为气态 | |
| B. | ②的反应物总能量比①的反应物总能量低 | |
| C. | ①的产物比②的产物热稳定性更好 | |
| D. | 1 mol固态碘升华时将吸热17 kJ |
1.某反应体系的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O.下列选项正确的是( )


| A. | Na2S4O6、H2O、Na2S2O3、Au2O、NaOH | |
| B. | Na2S2O3、H2O、Na2S4O6、Au2O、NaOH | |
| C. | Na2S2O3、NaOH、Na2S4O6、Au2O、H2O | |
| D. | 当1mol Au2O3完全反应时,转移电子的物质的量为8mol |
8.在标准状况下进行甲、乙、丙三组实验.三组实验均各取300mL同浓度的盐酸,加入同一种镁铝合金粉末,产生气体,有关数据见下表:
(1)甲、乙两组实验中,哪一组盐酸是不足量的?乙(填“甲”或“乙”).
(2)根据表中数据能否求得盐酸的物质的量浓度?能.(填“能”或“否”)
(3)求合金中Mg、Al的物质的量之比(写出计算过程)
| 实验序号 | 甲 | 乙 | 丙 |
| 盐酸体积/mL | 300 | 300 | 300 |
| 合金质量/g | 5.1 | 7.65 | 9.18 |
| 生成气体体积/L | 5.6 | 6.72 | 6.72 |
(2)根据表中数据能否求得盐酸的物质的量浓度?能.(填“能”或“否”)
(3)求合金中Mg、Al的物质的量之比(写出计算过程)
6.下列叙述正确的是( )
| A. | 1.0×10-3mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH=8.0 | |
| B. | 在醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b | |
| C. | 在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 | |
| D. | 常温若1mLpH=1的盐酸与100mLNaOH溶液混合后,溶液的pH=7则NaOH溶液的pH=11 |