题目内容
17.下列反应能瞬间完成的是( )| A. | 硝酸见光分解 | B. | 硝酸银溶液与盐酸的反应 | ||
| C. | 漂白粉失效 | D. | 二氧化硫被氧化为三氧化硫 |
分析 A.浓硝酸具有不稳定性,见光缓慢分解;
B.银离子与氯离子反应生成氯化银沉淀;
C.漂白粉与空气中二氧化碳和水缓慢反应生成碳酸钙和次氯酸,次氯酸分解生成氯化氢和氧气;
D.二氧化硫氧化生成三氧化硫为可逆反应,反应缓慢.
解答 解:A.浓硝酸具有不稳定性,见光缓慢分解生成二氧化氮和水,故A不选;
B.硝酸银溶液与盐酸发生复分解反应,能瞬间完成,故B选;
C.漂白粉与空气中二氧化碳和水缓慢反应生成碳酸钙和次氯酸,次氯酸分解生成氯化氢和氧气,反应较缓慢,故C不选;
D.二氧化硫氧化生成三氧化硫为可逆反应,反应缓慢,不能瞬间完成,故D不选;
故选:B.
点评 本题以元素化合物为载体考查物质之间反应速率快慢,明确物质的性质是解本题关键,知道铜绿生成时发生的反应,题目难度不大.

练习册系列答案
相关题目
7.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 能使酚酞变红的溶液:K+、Na+、NO3-、Cl- | |
| B. | 滴入少量KSCN溶液显红色的溶液中:Na+、K+、I-、SO42- | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1014的溶液:Ca2+、Na+、CH3COO-、NO3- | |
| D. | 由水电离的c(H+)=1×10-12 mol•L-1的溶液中:Ba2+、K+、Cl-、HCO3- |
8.在0.1mol•L-1NH3•H2O溶液中存在如下电离平衡:NH3•H2O?NH4++OH-.对于该平衡,下列叙述中正确的是( )
| A. | 加入水时,溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| B. | 加入少量NaOH固体,平衡向逆反应方向移动,电离平衡常数减小 | |
| C. | 加入少量0.1 mol•L-1HCl溶液,溶液中c(OH-)增大 | |
| D. | 降低温度,溶液中c(NH4+)增大 |
5.关于下列装置的说法中正确的是( )
| A. | 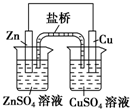 装置中,盐桥(含琼脂的饱和KCl溶液)中的K+移向ZnSO4溶液 | |
| B. | 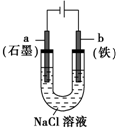 装置通电一段时间后溶液中有红褐色物质产生 | |
| C. | 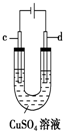 用装置精炼铜时,c极为粗铜 | |
| D. | 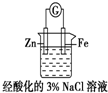 装置中电子由Zn电极沿外电路流向Fe电极,装置中有Fe2+生成 |
12.下列物质中,属于强电解质的是( )
| A. | H2O | B. | CH3COOH | C. | NH3•H2O | D. | AgCl |
2.反应4NH3(g)+5O2═4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此段时间内,该反应的速率v可表示为( )
| A. | v(NH3)=0.010mol/(L.s) | B. | v(O2)=0.010mol/(L.s) | ||
| C. | v(NO)=0.0010mol/(L.s) | D. | v(H2O)=0.045mol/(L.s) |
6. 在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析正确的是( )
在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析正确的是( )
 在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析正确的是( )
在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析正确的是( )| A. | 0~4 min时,A的平均反应速率为0.1 mol/(L•min) | |
| B. | 该反应是一个吸热反应 | |
| C. | 平衡后升高温度,K值增大 | |
| D. | 该反应的平衡常数表达式为:K=$\frac{c(C)}{{c}^{2}(A)c(B)}$ |
7.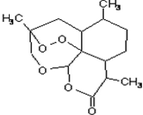 青蒿素是抗恶性疟疾特效药,结构如图所示,下列关于青蒿素的说法正确的是( )
青蒿素是抗恶性疟疾特效药,结构如图所示,下列关于青蒿素的说法正确的是( )
 青蒿素是抗恶性疟疾特效药,结构如图所示,下列关于青蒿素的说法正确的是( )
青蒿素是抗恶性疟疾特效药,结构如图所示,下列关于青蒿素的说法正确的是( )| A. | 分子式是C15H22O5 | |
| B. | 易溶于水,乙醇和乙醚 | |
| C. | 含有-O-O-键,具有较强的氧化性 | |
| D. | 1mol青蒿素可以和1molH2发生加成反应 |