题目内容
电子工业制造光电管时,需要一种经强光照射就失去电子从而接通电路的材料.制造这种材料的物质属于( )
| A、ⅦA族元素 | B、聚乙烯 |
| C、ⅠA族元素 | D、二氧化硅 |
考点:常见金属元素的单质及其化合物的综合应用
专题:化学应用
分析:根据金属活动顺序表和原子失电子的难易程度方面来分析,找原子半径最大,最外层电子最少,最容易失去电子的元素.
解答:
解:根据题意,金属的原子应该是一种经强光照射就失去电子的金属原子,要求金属的活泼性相当强,极易失去电子,
A、ⅦA族元素在同周期元素中原子半径小,得电子能力强,故A不选;
B、聚乙烯是最结构简单的高分子,也是应用最广泛的高分子材料,无法失去电子,故B不选;
C、ⅠA族元素在同周期元素中原子半径最大,最外层电子最少,最容易失去电子的元素,故选C;
D、二氧化硅用途很广泛,主要用于制玻璃、水玻璃、陶器、搪瓷、耐火材料、气凝胶毡、硅铁、型砂、单质硅、水泥,也是光导纤维的主要成份,故D不选.
故选C.
A、ⅦA族元素在同周期元素中原子半径小,得电子能力强,故A不选;
B、聚乙烯是最结构简单的高分子,也是应用最广泛的高分子材料,无法失去电子,故B不选;
C、ⅠA族元素在同周期元素中原子半径最大,最外层电子最少,最容易失去电子的元素,故选C;
D、二氧化硅用途很广泛,主要用于制玻璃、水玻璃、陶器、搪瓷、耐火材料、气凝胶毡、硅铁、型砂、单质硅、水泥,也是光导纤维的主要成份,故D不选.
故选C.
点评:本题主要考查学生根据题目信息结合金属活动顺序表来分析解决问题的能力,以金属活动顺序表为载体,来透视金属活动顺序表的其它应用.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
某同学对一无色透明溶液进行分析得出该溶液中含有下列某组离子,你认为该组离子应该是( )
| A、Al3+、NO3-、K+、SO42- |
| B、Ca2+、H+、HCO3-、Na+ |
| C、OH-、CO32-、Cu2+、SO42- |
| D、Fe3+、Mg2+、NO3-、Cl- |
下列金属或氧化物可以完全溶解的是( )
| A、1mol Zn与含1mol HCl的稀盐酸共热 |
| B、1mol Cu与含2mol H2SO4的浓硫酸共热 |
| C、1mol Cu与含4mol HNO3的浓硝酸 |
| D、1mol MnO2与含4mol HCl的浓盐酸共热 |
关于电解NaCl水溶液,下列叙述正确的是( )
| A、若在阴极附近的溶液中滴入酚酞试液,溶液呈无色 |
| B、若在阳极附近的溶液中滴入KI溶液,溶液呈棕色 |
| C、电解时在阳极得到氯气,在阴极得到金属钠 |
| D、电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性 |
2012年4月22日是第43个“世界地球日”,其主题为.“绿色梦想,低碳行动”.下列做法符合这一主题的是( )
①开发太阳能、风能和氢能等能源;②推广“煤气化”技术以提高煤的利用率;③在含硫的煤中加入适量生石灰;④利用苯、甲苯等有机物代替水作溶剂;⑤利用可降解的“玉米塑料”生产一次性饭盒.
①开发太阳能、风能和氢能等能源;②推广“煤气化”技术以提高煤的利用率;③在含硫的煤中加入适量生石灰;④利用苯、甲苯等有机物代替水作溶剂;⑤利用可降解的“玉米塑料”生产一次性饭盒.
| A、①②③⑤ | B、①②③④ |
| C、②③④⑤ | D、①②④⑤ |
下列物质中属于电解质的是( )
| A、二氧化碳 | B、银 |
| C、硫酸钡 | D、烧碱溶液 |
某高分子化合物的结构简式为 ,该物质可由下列哪组物质为原料直接合成得到( )
,该物质可由下列哪组物质为原料直接合成得到( )
 ,该物质可由下列哪组物质为原料直接合成得到( )
,该物质可由下列哪组物质为原料直接合成得到( )A、 和CH3CH2OH 和CH3CH2OH |
B、 和HOCH2CH2OH 和HOCH2CH2OH |
C、 和CH3CH2OH 和CH3CH2OH |
D、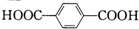 和HOCH2CH2OH 和HOCH2CH2OH |
