题目内容
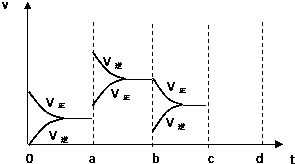
如图表示在密闭容器中反应:2SO2+O2?2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是 ;b c过程中改变的条件可能是 ; 若增大压强时,反应速度变化情况画在c~d处.

考点:化学平衡的影响因素
专题:
分析:根据影响化学反应速率和化学平衡的条件可作判断;根据压强对化学反应速率的影响可画出相关的图.
解答:
解:根据图可知,在a时刻,正逆反应速率都增大,且逆反应速率大于正反应速率,即平衡逆向移动,因为反应的△H<0,根据影响化学反应速率和化学平衡的条件可知,a~b过程中改变的条件可能是升温;在b时刻,正反应速率不变,逆反应速率减小,且正反应速率大于逆反应速率,即平衡正向移动,根据影响化学反应速率和化学平衡的条件可知,b~c过程中改变的条件可能是减小生成物C的浓度;在b~c过程后,若增大压强,正逆反应速率都会增大,由于该反应为体积缩小的反应,所以平衡正向移动,根据压强对化学反应速率的影响可画出相关的图为: ;
;
故答案为:升温;减小生成物的浓度; .
.
 ;
; 故答案为:升温;减小生成物的浓度;
 .
.
点评:本题考查了根据图象判断影响反应速率和化学平衡移动的外界因素等知识,难度不大,在看图二时要注间线的起点和正逆反应速率的相对大小,进而判断平衡移动方向.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
如图所示是分离混合物时常用的仪器,从左至右,可以进行的混合物分离操作分别是( )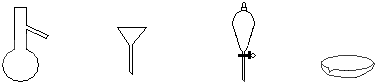
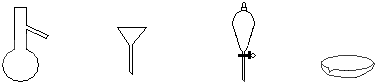
| A、蒸馏、蒸发、萃取、过滤 |
| B、过滤、蒸发、萃取、蒸馏 |
| C、萃取、过滤、蒸馏、蒸发 |
| D、蒸馏、过滤、萃取、蒸发 |
室温下,有关①100mL 0.1mol?L-1 NaHCO3、②100mL 0.1mol?L-1 Na2CO3两种溶液的叙述错误的是
( )
( )
| A、两溶液中水的电离度比较:②>① |
| B、分别加入少量NaOH固体,恢复到原温度,c(CO32-)均增大 |
| C、①溶液中:c(CO32-)<c(H2CO3) |
| D、②溶液中:c(HCO3-)<c(H2CO3) |
下列物质露置于干燥的空气中,不发生变化的是( )
| A、NaHCO3 |
| B、Na2O |
| C、Na2O2 |
| D、Na2CO3?10H2O |
在一定温度下,A2(g)+B2(g)?2AB(g)达到平衡的标志是( )
| A、单位时间内减少n mol A2,同时生成2n mol AB |
| B、单位时间内生成n mol B2,同时生成n mol AB |
| C、单位时间内生成 2xmol AB,同时生成xmol A2 |
| D、容器内各组成成分的物质的量之和不随时间变化而变化 |
为了说明影响化学反应快慢的因素,甲、乙、丙、丁四位学生分别设计了如下A~D四个实验,你认为结论不正确的是( )
| A、将铜片放入稀硫酸中,无现象.若再向所得的溶液中加入硝酸银溶液,一段时间后,由于形成原电池,可看到有氢气产生 |
| B、在相同条件下,等质量的大理石块和大理石粉与相同的盐酸反应,大理石粉反应快 |
| C、将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解 |
| D、两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 |
下列说法中不正确的是( )
| A、标准状况下,等体积的CH4和CO2所含共用电子对数相等 |
| B、与NaOH溶液、H2SO4溶液反应产生等量H2,所需铝粉质量相等 |
| C、1 mol OH-和17 g NH3所含电子数相等 |
| D、明矾溶液中K+和Al3+物质的量浓度相等 |