题目内容
10.工业上常用铁质容器盛装冷浓硫酸.为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是铁钉表面形成致密的氧化物薄膜,阻止铁和硫酸铜反应.
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y.
①甲同学认为X中除Fe3+外还可能含有Fe2+,若要确认其中的Fe2+,应选用d(选填序号).
a.KSCN溶液和氯水 b.H2O2 c.浓氨水 d.酸性KMnO4溶液
②乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O=2HBr+H2SO4,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g.由此推知气体Y中SO2的物质的量为0.01.分析上述实验中SO2物质的量的结果,丙同学认为气体Y中还可能含有H2和CO2气体.为此设计了下列探究实验装置(图中夹持仪器省略).
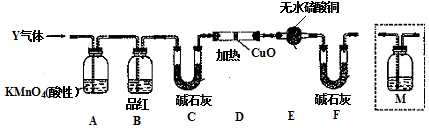
(3)装置B中试剂的作用是检验SO2是否除尽.
(4)认为气体Y中还含有CO2的理由是C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O(用化学方程式表示).
(5)为确认CO2的存在,需在装置中添加M于c(选填序号).
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是D中固体由黑变红,E中固体由白变蓝.
分析 (1)常温下,铁和浓硫酸发生钝化现象;
(2)①亚铁离子具有还原性,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色;
②根据SO2+Br2+2H2O═2HBr+H2SO4知,二氧化硫被氧化生成硫酸,硫酸和氯化钡反应生成硫酸钡沉淀,所以2.33g沉淀是BaSO4,n(BaSO4)=$\frac{2.33g}{233g/mol}$=0.01mol,根据S原子守恒得n(BaSO4)=n(S)=n(SO2)=0.01mol,标况下二氧化硫体积=0.01mol×22.4L/mol=224mL;
(3)品红溶液能检验二氧化硫存在;
(4)加热条件下,C和浓硫酸反应生成二氧化碳;
(5)碳和浓硫酸反应生成二氧化碳,所以Q为CO2,二氧化硫和二氧化碳都能使澄清石灰水变浑浊,所以应该在排除二氧化硫条件下将气体通入澄清石灰水中检验二氧化碳;
(6)氢气具有还原性,在加热条件下,能将黑色的CuO还原为红色的Cu,且生成水,水能使无水硫酸铜变蓝色.
解答 解:(1)常温下,铁和浓硫酸反应生成一层致密的氧化物薄膜而阻止进一步被氧化,该现象为钝化现象,所以将铁钉放入浓硫酸片刻无明显变化的原因是铁钉表面形成致密的氧化物薄膜,阻止铁和硫酸铜反应,
故答案为:铁钉表面形成致密的氧化物薄膜,阻止铁和硫酸铜反应;
(2)①a.氯水能将亚铁离子氧化为铁离子,铁离子和KSCN溶液反应导致溶液呈血红色,但不能确定原来溶液中一定含有亚铁离子,故错误;
b.铁粉和酸反应生成亚铁离子,不能确定原来溶液中是否含有亚铁离子,故错误;
c.浓氨水和亚铁离子反应生成氢氧化亚铁沉淀,氢氧化亚铁能被氧化生成氢氧化铁红褐色沉淀,不能确定溶液中一定含有亚铁离子,故错误;
d.亚铁离子具有还原性,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,所以可以用酸性高锰酸钾溶液检验亚铁离子,故正确;
故选d,
故答案为:d;
②根据SO2+Br2+2H2O═2HBr+H2SO4知,二氧化硫被氧化生成硫酸,硫酸和氯化钡反应生成硫酸钡沉淀,所以2.33g沉淀是BaSO4,n(BaSO4)=$\frac{2.33g}{233g/mol}$=0.01mol,根据S原子守恒得n(BaSO4)=n(S)=n(SO2)=0.01mol,
故答案为:0.01;
(3)品红溶液能检验二氧化硫存在,所以该装置的作用是检验SO2是否除尽,
故答案为:检验SO2是否除尽;
(4)加热条件下,C和浓硫酸反应生成二氧化碳,所以Q是二氧化碳,反应方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O;
(5)碳和浓硫酸反应生成二氧化碳,所以Q为CO2,二氧化硫和二氧化碳都能使澄清石灰水变浑浊,所以应该在排除二氧化硫条件下将气体通入澄清石灰水中检验二氧化碳,故选c,
故答案为:c;
(6)氢气具有还原性,在加热条件下,能将黑色的CuO还原为红色的Cu,且生成水,水能使无水硫酸铜变蓝色,所以如果Y中含有氢气,预计实验现象是D中固体由黑变红,E中固体由白变蓝,
故答案为:D中固体由黑变红,E中固体由白变蓝.
点评 本题考查性质实验方案评价,为高频考点,明确实验原理是解本题关键,知道每个装置可能发生的反应及其作用,难点是判断碱石灰作用,题目难度中等.

| A. | 在0℃,1.01×105 Pa时,11.2 L氮气所含原子数目为NA | |
| B. | 标准状况下,5.6 L SO3的质量约为20 g | |
| C. | 同温同压下,16 g CH4与44 g CO2具有相同的体积 | |
| D. | 标准状况下,CO和N2的密度相同 |
| A. | 丙烯(CH3CH=CH2)在一定条件下加聚后可得聚丙烯: | |
| B. | 某塑料 可由CF2=CF2和CF2=CFCF3通过加聚反应制得 可由CF2=CF2和CF2=CFCF3通过加聚反应制得 | |
| C. | 合成高分子  的单体是CF2=CF2 的单体是CF2=CF2 | |
| D. | 一种全降解塑料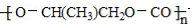 可由 可由  和 CO2在催化剂作用下加聚生成 和 CO2在催化剂作用下加聚生成 |
| A. | HF、HCl、HBr、HI的热稳定性依次减弱,酸性依次减弱 | |
| B. | 熔融状态下能导电的化合物一定含离子键;金属与非金属元素形成的化合物一定是离子化合物 | |
| C. | NCl3分子中所有的原子均为8电子稳定结构 | |
| D. | NaHSO4晶体中阴、阳离子的个数是1:2且熔化时破坏的是离子键和共价键 |
| A. | 甲烷和乙醇 | B. | 丙烯和丙烷 | C. | 乙酸和乙酸乙酯 | D. | 苯和乙烯 |
| A. | NO2的消耗速率与NO的生成速率相等 | |
| B. | 容器内气体的密度不随时间变化而变化 | |
| C. | NO2和O2的消耗速率之比为2:1 | |
| D. | 混合气体的质量不再变化 |
 甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间的转化关系如图所示(反应条件己略去).下列有关物质的推断正确的是( )
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间的转化关系如图所示(反应条件己略去).下列有关物质的推断正确的是( )| 甲 | 乙 | 丙 | 丁 | |
| A | N2 | NO | NO2 | O2 |
| B | CO32- | HCO3- | CO2 | H+ |
| C | Cl2 | FeCl3 | FeCl2 | Fe |
| D | Al3+ | Al(OH)3 | AlO2- | NH3•H2O |
| A. | A | B. | B | C. | C | D. | D |
 ;
; .
.