题目内容
2.下列有关实验操作、现象和解释或结论都正确的是( )| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向足量AgNO3溶液中先滴加少量NaCl溶液,后滴加少量KI溶液 | 先产生白色沉淀后又产生黄色沉淀 | AgI比AgCl更难溶 |
| B | 溴乙烷和烧碱的乙醇溶液共热 | 产生的气体可使酸性高锰酸钾溶液褪色 | 证明有乙烯生成 |
| C | 将高温水蒸气通过灼热的铁粉 | 铁粉变红 | 铁与水在高温下能发生反应 |
| D | Fe粉中加入过量的稀HNO3,充分反应后滴入几滴KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.硝酸银足量、氯化钠少量,则反应后有剩余的硝酸银,加入碘化钾后,碘离子与剩余的硝酸银反应,无法达到实验目的;
B.乙醇能够被酸性高锰酸钾溶液氧化,干扰了乙烯的检验;
C.铁与水蒸气在高温下反应生成的是四氧化三铁,四氧化三铁为黑色;
D.铁与过量稀硝酸反应生成硝酸铁,可用硫氰化钾溶液具有铁离子.
解答 解:A.加入的氯化钠应该过量,否则无法证明氯化银沉淀转化成碘化银,则无法证明Ksp(AgCl)>Ksp(AgI),故A错误;
B.加热过程中乙醇挥发,挥发出的乙醇能够被酸性高锰酸钾氧化,干扰了乙烯的检验,应该用溴水检验乙烯,故B错误;
C.将高温水蒸气通过灼热的铁粉,反应生成四氧化三铁和氢气,不会看到红色,故C错误;
D.Fe粉中加入过量的稀HNO3,然后滴入几滴KSCN溶液,溶液会变红,说明反应后溶液中含有铁离子,从而证明稀HNO3将Fe氧化为Fe3+,故D正确;
故选D.
点评 本题考查化学实验方案的评价,涉及沉淀的转化、物质的检验等知识,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同以及实验的严密性和可行性的评价,难度中等.

练习册系列答案
相关题目
12.现有如下各说法:
①在水中氢、氧原子间均以化学键相结合.
②金属和非金属化合形成的化学键必为离子键.
③离子键是阳离子、阴离子的相互吸引.
④元素的非金属性越强,其构成的单质越活泼.
⑤H2分子和Cl2分子的反应过程是H2、Cl2分子里共价键发生断裂生成H、Cl原子,而后H、Cl原子形成离子键的过程.
上述各种说法正确的是( )
①在水中氢、氧原子间均以化学键相结合.
②金属和非金属化合形成的化学键必为离子键.
③离子键是阳离子、阴离子的相互吸引.
④元素的非金属性越强,其构成的单质越活泼.
⑤H2分子和Cl2分子的反应过程是H2、Cl2分子里共价键发生断裂生成H、Cl原子,而后H、Cl原子形成离子键的过程.
上述各种说法正确的是( )
| A. | ①②⑤正确 | B. | 都不正确 | ||
| C. | ④正确,其他不正确 | D. | 仅①不正确 |
10.某研究小组将纯净的SO2气体通入0.1mol•L-1的Ba(NO3)2溶液中,得到了BaSO4沉淀.为探究上述溶液中何种微粒能氧化通入的SO2,该小组提出了如下假设:
假设一:溶液中的NO3-
假设二:溶液中溶解的O2;
(1)验证假设一
该小组设计实验验证了假设一,请在下表空白处填写相关实验现象.
(2)为深入研究该反应,该小组还测得上述两个实验中溶液pH随通入SO2体积的变化曲线如图:

实验1中溶液pH变小的原因是SO2溶于水后生成H2SO3,亚硫酸显酸性,故pH值减小;V1时,实验2中溶液pH小于实验1的原因是3SO2+2H2O+2NO3-=2NO+4H++3SO42-(用离子方程式表示).
(3)该小组还设计了实验验证假设二,请在实验4横线处写出实验步骤.
假设一:溶液中的NO3-
假设二:溶液中溶解的O2;
(1)验证假设一
该小组设计实验验证了假设一,请在下表空白处填写相关实验现象.
| 实验步骤 | 实验现象 | 结论 |
| 实验1:在盛有不含O2的25mL0.1mol•L-1BaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | 无现象 | 假设一成立 |
| 实验2:在盛有不含O2的25mL0.1mol•L-1Ba(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 | 白色沉淀生成 |

实验1中溶液pH变小的原因是SO2溶于水后生成H2SO3,亚硫酸显酸性,故pH值减小;V1时,实验2中溶液pH小于实验1的原因是3SO2+2H2O+2NO3-=2NO+4H++3SO42-(用离子方程式表示).
(3)该小组还设计了实验验证假设二,请在实验4横线处写出实验步骤.
| 实验步骤 | 实验现象 | 结论 |
| 实验3:在盛有不含O2的25m10.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | ||
| 实验4: |
7.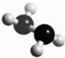 肼(N2H4)是火箭燃料,其分子的球棍模型如图所示.肼能与H2O2发生反应:N2H4+2H2O2═N2+4H2O.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
肼(N2H4)是火箭燃料,其分子的球棍模型如图所示.肼能与H2O2发生反应:N2H4+2H2O2═N2+4H2O.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
 肼(N2H4)是火箭燃料,其分子的球棍模型如图所示.肼能与H2O2发生反应:N2H4+2H2O2═N2+4H2O.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
肼(N2H4)是火箭燃料,其分子的球棍模型如图所示.肼能与H2O2发生反应:N2H4+2H2O2═N2+4H2O.设NA为阿伏伽德罗常数的值,下列说法正确的是( )| A. | 32g N2H4中含有共价键的总数为6NA | |
| B. | 标准状况下,22.4LH2O2中所含原子总数为4NA | |
| C. | 28g N2中含电子总数为7NA | |
| D. | 与17g H2O2所含非极性键数目相同的N2H4的分子总数为0.5NA |
3.下列解释实验现象的反应方程式正确的是( )
| A. | 切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2═Na2O | |
| B. | 向AgCl悬浊液中滴加NaI溶液,白色沉淀变成黄色AgCl+I-═AgI+Cl- | |
| C. | Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物2Na2O2+2CO2═2Na2CO3+O2 | |
| D. | 向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
4.下列有关实验的说法正确的是( )
| A. | 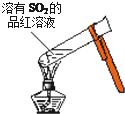 加热后溶液颜色变为无色 | B. |  配制100mL0.10mol•L-1NaCl溶液 | ||
| C. | 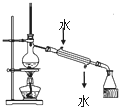 实验室用该装置制取少量蒸馏水 | D. |  称量25gNaOH |
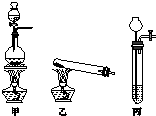 相对分子质量由小到大排列的X、Y、Z三种气体单质,组成这三种单质的元素分别位于不同的短周期.在一定条件下,X与Y化合生成M;X与Z化合生成N;M能与N化合生成A.实验室可分别用如图所示的发生装置制取X、Z和M(夹持装置已略).
相对分子质量由小到大排列的X、Y、Z三种气体单质,组成这三种单质的元素分别位于不同的短周期.在一定条件下,X与Y化合生成M;X与Z化合生成N;M能与N化合生成A.实验室可分别用如图所示的发生装置制取X、Z和M(夹持装置已略).
 工业上一般在密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)
工业上一般在密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)