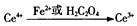题目内容
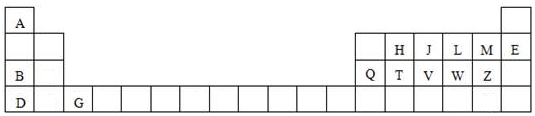
13.表为元素周期表的一部分:| IA | IIA | IIIA | IVA | VA | VIA | VIIA | ||
| 二 | C | N | ① | |||||
| 三 | ② | ③ | ④ | P | ⑤ | ⑥ |
(1)表中元素,原子半径最大的是Na(填写元素符号);①的核外电子排布式1s22s22p4;③和⑥两元素形成化合物的电子式为
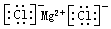 .
.(2)②③④三种元素最高价氧化物对应的水化物中,碱性最强的是NaOH(填化学式).
(3))比较④、⑤两种元素的简单离子半径:S2->Al3+(填离子符号);元素④最高价氧化物对应的水化物与硝酸反应的离子方程式为Al(OH)3+3H+=Al3++3H2O.
(4))列举一个事实来证明元素①比元素⑤的非金属性强H2O的稳定性大于H2S.
(5))若8g甲烷气体完全燃烧生成液态水时放出445.15kJ的热量,请写出其热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ•mol-1.
分析 由元素在周期表中位置,可知①为O、②为Na、③为Mg、④为Al、⑤为S、⑥为Cl.
(1)同周期自左而右原子半径减小,电子层越多原子半径越大;氧元素为8号元素,原子核外有8个电子;③和⑥两元素形成化合物为氯化镁,属于离子化合物,镁离子与氯离子通过离子键结合;
(2)金属性越强,最高价氧化物对应水合物的碱性越强;
(3)电子层数越多离子半径越大,电子层结构相同的离子,其离子半径随着原子序数增大而减小;元素④最高价氧化物对应的水化物为氢氧化铝,与硝酸生成硝酸铝和水,据此书写离子方程式;
(4)利用非金属与氢气化合的难易程度、气态氢化物的稳定性、最高价氧化物的水化物的酸性、非金属单质之间的置换反应等来判断非金属性的强弱;
(5)n(CH4)=$\frac{8g}{16g/mol}$=0.5mol,完全燃烧生成液态水时放出的热量是445.15kJ,则1mol计算完全燃烧放出的能量结合热化学方程式的书写方法进行书写.
解答 解:(1)由元素在周期表中位置,可知①为O、②为Na、③为Mg、④为Al、⑤为S、⑥为Cl,电子层越多原子半径越大,所以第三周期的元素半径大于第二周期的元素,
同周期自左而右原子半径减小,表中元素,原子半径最大的是Na,①为O为8号元素,原子核外有8个电子,核外电子排布式为1s22s22p4,③和⑥两元素形成化合物为氯化镁,氯化镁是离子化合物,由镁离子与氯离子构成,电子式为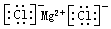 ,
,
故答案为:Na;1s22s22p4;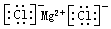 ;
;
(2)②为Na、③为Mg、④为Al,三者位于同一周期,金属性Na>Mg>Al,则最高价氧化物对应水合物的碱性最强的为NaOH,
故答案为:NaOH;
(3)S2-核外有三层电子,结构示意图为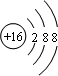 ,Al3+核外有两层电子,结构示意图为:
,Al3+核外有两层电子,结构示意图为: .离子电子层数越多,离子半径越大,则离子半径S2->Al3+,元素④最高价氧化物对应的水化物为氢氧化铝,与硝酸生成硝酸铝和水,硝酸、硝酸铝拆成离子,离子方程式为:Al(OH)3+3H+=Al3++3H2O,
.离子电子层数越多,离子半径越大,则离子半径S2->Al3+,元素④最高价氧化物对应的水化物为氢氧化铝,与硝酸生成硝酸铝和水,硝酸、硝酸铝拆成离子,离子方程式为:Al(OH)3+3H+=Al3++3H2O,
故答案为:S2-;Al3+;Al(OH)3+3H+=Al3++3H2O;
(4)元素的非金属性越强,对应氢化物的稳定性越强,H2O的稳定性大于H2S,则O的非金属性比S的强,
故答案为:H2O的稳定性大于H2S;
(5)8g甲烷n(CH4)=$\frac{8g}{16g/mol}$=0.5mol,完全燃烧生成液态水时放出的热量是445.15kJ,则1mol计算完全燃烧放出890.3KJ的能量,所以热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ•mol-1,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ•mol-1.
点评 本题考查元素周期表与元素周期律综合应用,为高频考点,题目难度中等,熟练掌握金属性、非金属性强弱、离子半径大小的比较方法是解答关键.

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案| A. | 海水淡化的方法有蒸馏法、离子交换法、电渗析法等 | |
| B. | 明矾水解时能生成具有吸附性的胶体粒子,故可用于消毒杀菌 | |
| C. | Ba2+对人体无毒,故BaSO4在医学上可用作“钡餐” | |
| D. | 与铜质水龙头连接处的铜质水管不易发生腐蚀 |
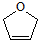 是一种有机烯醚,可由链烃A通过下列路线制得,下列说法正确的是( )
是一种有机烯醚,可由链烃A通过下列路线制得,下列说法正确的是( )A$→_{①}^{Br_{2}/CCl_{4}}$B$→_{②}^{NaOH溶液}$C$→_{△③}^{浓H_{2}SO_{4}}$
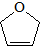
| A. | B中含有的官能团有溴原子、碳碳双键 | |
| B. | A的结构简式是CH2═CHCH2CH3 | |
| C. | 该有机烯醚不能发生加聚反应 | |
| D. | ①②③的反应类型分别为加成反应、取代反应、消去反应 |
| A. | 7.8gNa2O2中含阴离子的数目为0.1NA | |
| B. | 25℃时,1L pH=1的H2SO4溶液中含H+的数目为0.2NA | |
| C. | 9.0g淀粉和葡萄糖的混合物中含碳原子的数目为0.3NA | |
| D. | 将10mL 1mol/L FeCl3溶液滴入沸水中,所得氢氧化铁胶粒的数目为0.01NA |
| 目的 | 古代文献 | 说明 | |
| A | 使用 | 《周礼》:“煤饼烧蛎房(牡蛎壳)成灰”,蔡伦造纸用此“灰”溶于水沤浸树皮脱胶. | “灰”的主要成分是氧化钙 |
| B | 鉴别 | 《新修本草》:硝石“如握盐雪不冰,强烧之,紫青烟起”,用于区分硝石(KNO3)和朴硝(Na2SO4) | 利用颜色反应 |
| C | 浸出 | 《肘后备急方》:“青蒿一握,以水二升渍,绞取汁,尽服之”. | 提取青蒿素中的纤维素 |
| D | 性质 | 《本草纲目》:“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以为烽燧机诸药者”. | 利用KNO3的氧化性 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 化学电池可将电能转变为化学能 | |
| B. | 化学反应一定伴随着能量变化 | |
| C. | 燃料燃烧能将化学能转变为热能 | |
| D. | 植物的光合作用将太阳能转化为化学能 |
| 装置 | 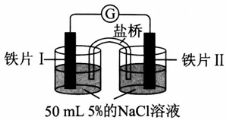 | 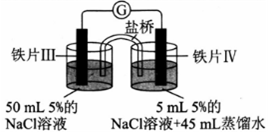 |
| 现象 | 电流计指针未发生偏转 | 电流计指针偏转 |
| A. | 加热铁片I所在烧杯,电流表指针会发生偏转 | |
| B. | 用KSCN溶液检验铁片Ⅲ、IV附近溶液,可判断电池的正、负极 | |
| C. | 铁片I、Ⅲ的腐蚀速率相等 | |
| D. | “电流计指针未发生偏转”,说明铁片I、铁片Ⅱ均未被腐蚀 |
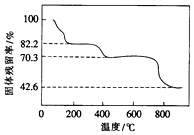 硫酸高铈[Ce(SO4)2]是一种常用的强氧化剂.
硫酸高铈[Ce(SO4)2]是一种常用的强氧化剂.