题目内容
8.1g金属钾和水反应放出250mL氢气(标准状况下),试计算金属钾的纯度.分析 K和水反应方程式为2K+2H2O=2KOH+H2↑,根据转移电子相等计算K的质量,再根据质量分数计算K的纯度.
解答 解:K和水反应方程式为2K+2H2O=2KOH+H2↑,根据转移电子相等得m(K)=$\frac{\frac{0.25L}{22.4L/mol}×2}{1}×39g/mol$=0.804g,则K的纯度=$\frac{0.804g}{1g}×100%$=87%,
答:钾的纯度为87%.
点评 本题考查化学方程式有关计算,侧重考查学生分析计算能力,可以根据转移电子守恒或方程式计算,题目难度不大.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案
相关题目
16.实验室测得1mol SO2发生下列化学反应:2SO2(g)+O2(g)?2SO3(g)△H=-196kJ/mol.当放出49kJ热量时,SO2转化率最接近于( )
| A. | 40% | B. | 50% | C. | 80% | D. | 90% |
13.下列与化学反应能量变化相关的叙述正确的是( )
| A. | 生成物总能量一定低于反应物总能量 | |
| B. | △H的大小与热化学方程式的计量系数无关 | |
| C. | 应用盖斯定律可计算某些难以直接测量的反应烩变 | |
| D. | 同温同压下,H2(g)十Cl2(g)=2HC1(g)在光照和点燃条件下的△H不同 |
20.下列说法正确的是( )
| A. | 升高温度均可以使氨水、氯化铵溶液中c(NH4+)增大 | |
| B. | H2O是一种弱电解质 | |
| C. | 用托盘天平称量NaOH固体时,需在左右托盘上各方一块质量相等的滤纸 | |
| D. | 用25mL滴定管量取25.00mLNaOH溶液时,需将调好零点的滴定管中所有液体放出 |
17.某溶液中可能含有下列5种离子中的某几种:K+、NH4+、Mg2+、Al3+、Cl-.为确认该溶液组成进行如下实验:①取10.0mL该溶液,加入25.0mL 2.00 mol•L-K0H溶液,有白色沉淀,无刺激气味气体.过滤、洗涤、干燥,得沉淀0.58g.再将滤液稀释至50mL,测得滤液中c(OH-)=0.20mol•L-;②另取10.0mL该溶液,加人足量的AgNO3溶液,生成白色沉淀5.74g.由此可得出关于原溶液组成的正确结论是( )
| A. | 一定含有Mg+、Al3+、Cl-,不含K+、NH4+ | |
| B. | 一定含有K+、Mg2+、Cl-,不含NH4+,可能含有Al3+ | |
| C. | c(Mg2+)=1.00mol•L-1,c(Cl-)=4.00mol•L-1 | |
| D. | c(K+)=0.50mol•L-1,c(Al3+)=1.00mol•L-1 |
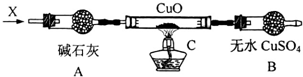 铜是常见的变价金属.为了比较正一价铜和正二价铜的稳定性,并研究氧化铜的氧化性,某化学小组的同学进行了以下实验.
铜是常见的变价金属.为了比较正一价铜和正二价铜的稳定性,并研究氧化铜的氧化性,某化学小组的同学进行了以下实验. 燃煤厂为减少SO2的排放,可采取的措施是:
燃煤厂为减少SO2的排放,可采取的措施是: