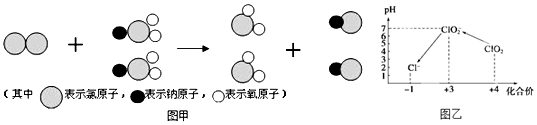
题目内容
6.用下图装置进行实验.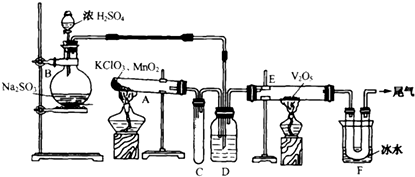
回答有关问题:
(1)玻璃管E内发生反应的化学方程式是2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3.
(2 )小试管C的作用是防止倒吸.
(3)广口瓶D内盛的试剂是浓硫酸,装置D的3个作用是①干燥SO2,②使SO2和O2两种气体混合均匀,③通过观察气泡控制气体比例和气流速度.
(4)从管E导出的气体成分是SO3、SO2、O2.
(5)装置F中U形管观察到所收集物质的颜色状态是无色固体.
(6)若U形管内收集到的物质很少,分析其原因不可能是b(填标号).
a.装置气密性不好; b.制得的SO2中混有少量H2S杂质使催化剂中毒;c.气流速度过快
(7)从U形管导出的尾气的处理方法是用NaOH溶液吸收.
分析 (1)二氧化硫与氧气在催化剂作用下反应生成三氧化硫;
(2)小试管C起安全瓶的作用防止倒吸;
(3)广口瓶中盛放浓硫酸,可以干燥气体,同时使SO2和O2两种气体混合均匀,控制气体的比例和流速;
(4)依据可逆反应不能进行到底的特点解答;
(5)依据三氧化硫物理性质解答;
(6)若U形管内收集到的物质很少的原因可能是漏气、生成气体流速过快,过程中不能生成硫化氢;
(7)剩余二氧化硫气体有毒污染空气,需要用碱溶液吸收.
解答 解:(1)二氧化硫与氧气在催化剂作用下反应生成三氧化硫,方程式:2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3;
故答案为:2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3;
(2)小试管C起安全瓶的作用防止倒吸;
故答案为:防止倒吸;
(3)广口瓶中盛放浓硫酸的三个作用为:①干燥气体,②使SO2和O2两种气体混合均匀③控制气体的比例和流速;
故答案为:①干燥气体,②使SO2和O2两种气体混合均匀③控制气体的比例和流速;
(4)二氧化硫与氧气反应生成三氧化硫为可逆反应,不能进行到底,所以反应后气体含有SO3、SO2、O2;
故答案为:SO3、SO2、O2;
(5)三氧化硫为无色固体,所以装置F中U形管观察到所收集物质的颜色状态为无色固体;
故答案为:无色固体;
(6)若U形管内收集到的物质很少的原因可能是a装置气密性不好,c气流速度过快,过程中无法制得H2S杂质,b不可能,
故答案为:b;
(7)剩余二氧化硫气体有毒污染空气,需要用碱溶液吸收,SO2+2NaOH=Na2SO3+H2O,
故答案为:应用NaOH溶液吸收.
点评 本题考查了三氧化硫的制备,明确二氧化硫、氧气的制备原理,明确二氧化硫与氧气反应为可逆反应特点是解题关键,注意装置作用分析、物质性质的记忆,题目难度中等.

 阅读快车系列答案
阅读快车系列答案反应Ⅰ.2NH4Cl+MgO$\frac{\underline{\;500~550℃\;}}{\;}$2NH3↑+MgCl2+H2O↑
反应Ⅱ.2MgCl2+O2$\frac{\underline{\;800~1000℃\;}}{\;}$2MgO+2Cl2
下列说法正确的是( )
| A. | 该工艺中MgO可循环利用 | |
| B. | 理论上 1mol NH4Cl制得Cl2的体积一定为11.2L | |
| C. | 在800~1000℃条件下,O2的还原性强于Cl2的还原性 | |
| D. | 若反应2NH3+MgCl2+H2O═2NH4Cl+MgO能自发进行,则该反应△H>0 |
| A. | H2S溶液中只存在2个电离平衡 | |
| B. | c(OH-)=$\sqrt{{K}_{w}}$的溶液一定呈中性 | |
| C. | 加热碳酸钠溶液可证明其水解是吸热反应 | |
| D. | 常温下,在AlPO4和FePO4的饱和溶液中滴加少量Na3PO4溶液,Ksp(AlPO4)和Ksp(FePO4)将减小 |
| A. | 标准状况下,2.24 L乙醇中碳氢键的数目为0.5 NA | |
| B. | 1 L 0.1 mol•L-1硫酸钠溶液中含有的氧原子数为0.4 NA | |
| C. | 0.1 mol KI与0.1 mol FeCl3在溶液中反应转移的电子数为0.1 NA | |
| D. | 0.1 mol乙烯与乙醇的混合物完全燃烧所消耗的氧分子数为0.3 NA |
| 温度 | 1760℃ | 2400℃ | 2730℃ |
| 平衡常数 | 2.4×10-4 | 6.4×10-3 | 8.9×10-3 |
A.消耗1mol N2同时生成1mol O2 B.混合气体密度不变
C.混合气体平均相对分子质量不变 D.2v(N2)正=v(NO)逆
(2)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是AC(填字母序号).
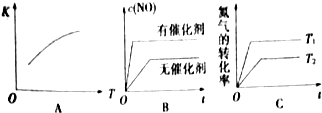
(3)在2400℃时向2L密闭容器中充入N2和O2各1mol,平衡时N2的转化率是4%(保留整数);平衡后再向其中充入1molNO,重新达到化学平衡状态,与原平衡状态相比,此时平衡混合气中NO的体积分数不变(填“变大”、“变小”或“不变”).
(4)为了减轻大气污染,人们提出通过以下反应来处理汽车尾气2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=a kJ•mol-1,为了测定在某种催化剂作用下该反应的反应速率,t℃时在一等容的密闭容器中,在上述条件下该反应能自发进行,某科研机构用气体传感器测得了不同时间的NO和CO的浓度如下表(CO2和N2的起始浓度均为0).
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/10-4mol/L | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/10-3mol/L | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①a小于0(填“大于”或“小于”).
②假设在密闭容器中发生上述处理汽车尾气反应,达到平衡时改变下列条件,能提高NO转化率的是
CD.
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积.
③t℃时2NO(g)+2CO(g)?N2(g)+2CO2(g)反应的平衡常数K=5000.
| A. | 4g | B. | 5g | C. | 6g | D. | 7g |
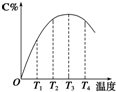 可逆反应A(g)+B(g)?2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示.
可逆反应A(g)+B(g)?2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示.