题目内容
下列电子式书写正确的是( )
A、N2  |
B、NH3  |
C、H2O  |
D、NaCl  |
考点:电子式
专题:化学键与晶体结构
分析:A.氮气分子中存在3对共用电子对,氮气分子中的共用电子对的表示方法不规范;
B.氨气分子中存在3个氮氢键,氮原子最外层达到8电子稳定结构;
C.水为共价化合物,分子中不存在阴阳离子;
D.氯化钠为离子化合物,化学式中存在钠离子和氯离子.
B.氨气分子中存在3个氮氢键,氮原子最外层达到8电子稳定结构;
C.水为共价化合物,分子中不存在阴阳离子;
D.氯化钠为离子化合物,化学式中存在钠离子和氯离子.
解答:
解:A.氮气分子中存在氮氮三键,电子式中3对共用电子对的表示方法错误,正确的表示方法为: ,故A错误;
,故A错误;
B.氨气的电子式中,氮原子最外层达到8个电子,氨气的电子式为: ,故B错误;
,故B错误;
C.水为共价化合物,分子中不存在阴阳离子,水的电子式为: ,故C错误;
,故C错误;
D.氯化钠为离子化合物,氯离子需要标出最外层电子,氯化钠的电子式为: ,故D正确;
,故D正确;
故选D.
 ,故A错误;
,故A错误;B.氨气的电子式中,氮原子最外层达到8个电子,氨气的电子式为:
 ,故B错误;
,故B错误;C.水为共价化合物,分子中不存在阴阳离子,水的电子式为:
 ,故C错误;
,故C错误;D.氯化钠为离子化合物,氯离子需要标出最外层电子,氯化钠的电子式为:
 ,故D正确;
,故D正确;故选D.
点评:本题考查了电子式的书写判断,题目难度中等,注意掌握电子式的概念及正确表示方法,明确离子化合物与共价化合物的电子式的表示方法及区别.

练习册系列答案
相关题目
已知断开1mol H-H键吸收的能量为436kJ,断开1mol H-N键吸收的能量为391kJ,根据化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1,则断开1mol N≡N键吸收的能量是( )
| A、431 kJ |
| B、945.6 kJ |
| C、649 kJ |
| D、869 kJ |
氯碱工业的产物NaOH与不同物质反应可以生成不同的盐.已知常温下,浓度均为0.1mol?L-1的4种钠盐溶液的pH如下表:
下列说法中正确的是( )
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
| A、向氯水中加入NaHCO3溶液,可以增大氯水中次氯酸的浓度 |
| B、四种溶液中,水的电离程度最大的是NaClO |
| C、常温下,相同物质的量浓度的H2SO3、H2CO3、HClO溶液,pH最大的是H2SO3溶液 |
| D、NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>c(OH-) |
下列说法正确的是( )
| A、用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗上口倒出 |
| B、使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干 |
| C、检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 |
| D、用10mL量筒量取9.2mL NaCl溶液 |
下列叙述错误的是( )
①热稳定性:H2O>HF>H2S
②熔点:Al>Na>K
③ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤多电子原子中,在离核较近的区域内运动的电子能量较高
⑥盐酸可以碳酸钠溶液反应生成CO2气体,说明盐酸比碳酸强,Cl 比S的非金属性强
⑦SiCl4、PCl3分子中各原子最外层均达到8电子稳定结构.
①热稳定性:H2O>HF>H2S
②熔点:Al>Na>K
③ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤多电子原子中,在离核较近的区域内运动的电子能量较高
⑥盐酸可以碳酸钠溶液反应生成CO2气体,说明盐酸比碳酸强,Cl 比S的非金属性强
⑦SiCl4、PCl3分子中各原子最外层均达到8电子稳定结构.
| A、①③⑤⑥ | B、②④⑥ |
| C、②③④⑦ | D、①⑤⑥ |
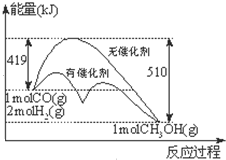 反应CO(g)+2H2(g)?CH3OH(g)过程中能量的变化如图示.下列判断不正确的是( )
反应CO(g)+2H2(g)?CH3OH(g)过程中能量的变化如图示.下列判断不正确的是( )| A、达到平衡时,升高温度,CO的转化率减小 |
| B、1mol CO(g)和2mol H2(g)在密闭容器中反应,达平衡时,放出的热量为91KJ |
| C、相同条件下,1mol CO(g)和2mol H2(g)完全反应生成1mol液态CH3OH放出的热量大于91KJ |
| D、反应热取决于反应物总能量与生成物总能量的相对大小,与反应发生的条件无关 |
下列说法正确的是( )
| A、两种元素组成的分子中一定只有极性键 |
| B、含有阴离子的化合物一定含有阳离子 |
| C、干冰升华时,分子内共价键会发生断裂 |
| D、金属元素和非金属元素形成的化合物一定是离子化合物 |
利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述不正确的是( )
| A、电解时以精铜作阴极 |
| B、电解时阴极发生还原反应 |
| C、粗铜连接电源负极,其电极反应有:Cu-2e-=Cu2+、Fe-2e-=Fe2+、Zn-2e-=Zn2+ |
| D、电解后,电解槽底部会形成含少量Ag、Pt等金属的阳极泥 |