题目内容
(1)火箭推进器中有燃料肼(N2H4)和液态双氧水,它们反应产生氮气和水蒸气并放出热.已知:0.4mol液态肼与足量的液态双氧水反应生成氮气和水蒸气,放出256.652kJ的热量.该反应的热化学方程式
(2)磷单质同磷灰石在高温下制备黄磷(P4)的热化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g);△H已知相同条件下:
4Ca3(PO4)2F(s)+3SiO2(s)=6Cas3(PO4)2(s)+2CaSiO3(s)+SiF4(g);△H1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g);△H2
SiO2(s)+CaO(s)=CaSiO3(s);△H3
用△H1、△H2和△H3表示△H,△H= .
(2)磷单质同磷灰石在高温下制备黄磷(P4)的热化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g);△H已知相同条件下:
4Ca3(PO4)2F(s)+3SiO2(s)=6Cas3(PO4)2(s)+2CaSiO3(s)+SiF4(g);△H1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g);△H2
SiO2(s)+CaO(s)=CaSiO3(s);△H3
用△H1、△H2和△H3表示△H,△H=
考点:用盖斯定律进行有关反应热的计算
专题:化学反应中的能量变化
分析:(1)反应方程式为:N2H4+2H2O2=N2+4H2O,根据0.4mol液态肼放出的热量,计算1mol液态肼放出的热量,进而写出热化学方程式;
(2)根据已知热化学方程式,利用盖斯定律构造目标热化学方程式,然后计算出其焓变.
(2)根据已知热化学方程式,利用盖斯定律构造目标热化学方程式,然后计算出其焓变.
解答:
解:(1)反应方程式为:N2H4+2H2O2═N2+4H2O,0.4mol液态肼放出256.652KJ的热量,则1mol液态肼放出的热量为:
=641.63kJ,
所以反应的热化学方程式为:N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63kJ/mol,
故答案为:N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.63kJ/mol;
(2)目标热化学方程式为:4Ca5(PO4)3F(s)+2lSiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4,
①4Ca3(PO4)2F(s)+3SiO2(s)=6Cas3(PO4)2(s)+2CaSiO3(s)+SiF4(g);△H1
②2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g);△H2
③SiO2(s)+CaO(s)=CaSiO3(s);△H3
根据盖斯定律,将①+②×3+③×18可得:4Ca5(PO4)3F(s)+2lSiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4 ;△H=△H1+3△H2+18△H3,
故答案为:△H1+3△H2+18△H3.
| 256.652kJ |
| 0.4mol |
所以反应的热化学方程式为:N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63kJ/mol,
故答案为:N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.63kJ/mol;
(2)目标热化学方程式为:4Ca5(PO4)3F(s)+2lSiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4,
①4Ca3(PO4)2F(s)+3SiO2(s)=6Cas3(PO4)2(s)+2CaSiO3(s)+SiF4(g);△H1
②2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g);△H2
③SiO2(s)+CaO(s)=CaSiO3(s);△H3
根据盖斯定律,将①+②×3+③×18可得:4Ca5(PO4)3F(s)+2lSiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4 ;△H=△H1+3△H2+18△H3,
故答案为:△H1+3△H2+18△H3.
点评:本题考查了热化学方程式的书写、盖斯定律的应用,题目难度中等,注意掌握热化学方程式的概念及书写原则,明确盖斯定律的内容及应用方法,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
下列化学用语表达正确的是( )
| A、N2的结构式::N≡N: |
B、NaCl的电子式: |
| C、Cr的价层电子排布图:3d54s1 |
D、F-的结构示意图: |
已知下列热化学方程式:
①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
②CO(g)+
O2(g)═CO2(g)△H=-283.0kJ/mol
③2Fe(s)+3CO(g)═Fe2O3(s)+3C(s)△H=-489.0kJ/mol
则4Fe(s)+3O2(g)═2Fe2O3(s)的反应热△H为( )
①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
②CO(g)+
| 1 |
| 2 |
③2Fe(s)+3CO(g)═Fe2O3(s)+3C(s)△H=-489.0kJ/mol
则4Fe(s)+3O2(g)═2Fe2O3(s)的反应热△H为( )
| A、-1641.0kJ/mol |
| B、+3081kJ/mol |
| C、+663.5kJ/mol |
| D、-2507.0kJ/mol |
 向如图装置的试管中加入某种物质后,U形管右边支管的红墨水液面降低,左边支管的红墨水液面上升,则加入的物质是( )
向如图装置的试管中加入某种物质后,U形管右边支管的红墨水液面降低,左边支管的红墨水液面上升,则加入的物质是( )| A、氢氧化钠 | B、硝酸铵 |
| C、浓硫酸 | D、生石灰 |

 -COOH.A、B、C、D、E的相互转化关系如图所示:
-COOH.A、B、C、D、E的相互转化关系如图所示: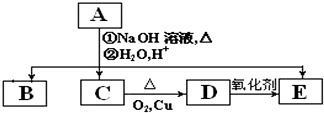
 某兴趣小组同学共同设置了如图所示的实验装置,即可用于制取气体,又可用于验证物质的性质.请回答下列问题:
某兴趣小组同学共同设置了如图所示的实验装置,即可用于制取气体,又可用于验证物质的性质.请回答下列问题: