题目内容
一定温度下,容积为2 L的甲、乙两固定容积的密闭容器中,发生反应:2SO2(g)+O2(g)  2SO3(g)。达平衡时测得有关数据如下表。
2SO3(g)。达平衡时测得有关数据如下表。
容器 | 甲 | 乙 |
反应物投入量 | 2 mol SO2、1 mol O2 | 4 mol SO3 |
n(SO3)/mol | 1.6 | a |
反应物的转化率 | α1 | α2 |
下列说法正确的是( )。
A.α1+α2>1
B.1.6<a<3.2
C.若甲中反应2 min时达到平衡,则2 min 内平均速率v(O2)=0.2 mol·L-1·min-1
D.甲平衡后再加入0.2 mol SO2、0.2 mol O2和0.4 mol SO3,平衡正向移动
CD
【解析】乙容器中投入4 mol SO3,相当于投入4 mol SO2、2 mol O2,刚好是甲容器投入量的两倍,可以看成是在两个甲容器中分别投入2 mol SO2、1 mol O2,平衡时分别与甲相同。此时,甲中生成的SO3的物质的量正好等于每份容器中剩余的SO3,所以α1+α3=1。然后加压将两份容器压缩成1个甲容器大小,若平衡不移动,各物质的物质的量均不变, n(SO3)= 1.6 mol×2=3.2 mol。由于该反应是气体化学计量数减小的反应,加压平衡正向移动得到更多SO3,所以乙容器中n(SO3)> 3.2 mol,而且α2<α3,即α1+α2<1,A、B错误。
一定温度下,甲容器中:
2SO2(g) + O2(g)  2SO3(g)
2SO3(g)
初始浓度
(mol·L-1) 1 0.5 0
变化浓度
(mol·L-1) 0.8 0.4 0.8
平衡浓度
(mol·L-1) 0.2 0.1 0.8
v(O2)= 0.4 mol·L-1 ÷ 2 min = 0.2 mol·L-1·min-1,C项正确。
平衡常数为:K= =
=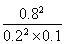 =160。
=160。
D项浓度商为:Qc= =
= =
= <160,所以平衡正向移动,正确。
<160,所以平衡正向移动,正确。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案V、W、X、Y均是元素周期表中短周期元素,在周期表中的相对位置关系如表所示:
| Y | V |
|
|
X |
|
|
| W |
Z为第四周期常见元素,该元素是人体血液中血红蛋白最重要的组成金属元素。V的最简单氢化物为甲,W的最简单氢化物为乙,甲、乙混合时有白烟生成。下列说法正确的是( )。
A.原子半径:X>Y>V>W
B.X、W的质子数之和与最外层电子数之和的比值为2∶1
C.甲、乙混合时所生成的白烟为离子化合物,但其中含有共价键
D.少量Z的单质与过量W的单质可化合生成ZW2



