题目内容
3.关于Si的叙述中,错误的是( )| A. | 晶体硅的结构类似于金刚石 | |
| B. | 硅是良好的半导体材料 | |
| C. | 硅的性质较稳定,在自然界中存在游离态 | |
| D. | 可以用焦炭还原二氧化硅生成硅:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ |
分析 A.硅晶体属于原子晶体,每个Si原子形成4个共价键;
B.硅的导电性介于导体与绝缘体;
C.硅在自然界中以化合态存在;
D.碳与二氧化硅反应生成硅和一氧化碳.
解答 解:A.硅晶体属于原子晶体,每个Si原子形成4个共价键,硅晶体的结构与金刚石类似,故A正确;
B.硅的导电性介于导体与绝缘体,是良好的半导体,故B正确;
C.硅在自然界中以化合态存在,自然界中无游离态硅,故C错误;
D.碳与二氧化硅反应生成硅和一氧化碳,化学方程式:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,故D正确;
故选:C.
点评 本题考查了元素化合物知识,明确硅及其化合物性质是解题关键,注意晶体硅及金刚石的结构,题目难度不大.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
13.下列有关化学平衡常数K的说法中,正确的是( )
| A. | K的大小与起始浓度有关 | B. | 温度越高,K值越大 | ||
| C. | K值越大,反应正向进行的程度越大 | D. | K值越大,反应正向进行的程度越小 |
11.LiAl/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e-→Li2S+Fe,有关该电池的下列说法中,正确的是( )
| A. | 负极的电极反应式为Al-3e-→Al3+ | |
| B. | 该电池的总反应式为2Li+FeS═Li2S+Fe | |
| C. | LiAl在电池中作为负极材料,该材料中Li的化合价为+1 | |
| D. | 充电时,阴极发生的电极反应式为Li2S+Fe-2e-═2Li++FeS |
18.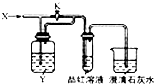 向图所示的装置中缓慢通入气体X,若打开活塞K,品红溶液褪色;若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊.X和Y可能是( )
向图所示的装置中缓慢通入气体X,若打开活塞K,品红溶液褪色;若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊.X和Y可能是( )
 向图所示的装置中缓慢通入气体X,若打开活塞K,品红溶液褪色;若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊.X和Y可能是( )
向图所示的装置中缓慢通入气体X,若打开活塞K,品红溶液褪色;若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊.X和Y可能是( ) | A | B | C | D | |
| X | SO2 | Cl2 | HCl | NO2 |
| Y | NaOH溶液 | 饱和NaCO3溶液 | 饱和NaCl溶液 | Na2SO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
8.下列不正确的是( )
| A. | 撒落的汞可用硫粉处理 | B. | 浓硫酸可用铁制容器装 | ||
| C. | 可用氨水清洗试管壁上的氧化铝 | D. | 可用稀硝酸清洗试管壁上的银 |
15.下列关于物质分类的表述,正确的说法是( )
| A. | 根据分散质粒子能否透过滤纸,可以将分散系分为溶液、胶体和浊液 | |
| B. | 根据某物质中是否含有氢元素,判断该物质是否属于酸 | |
| C. | 根据化学反应前后,是否有电子转移,判断反应是否属于氧化还原反应 | |
| D. | 根据某物质中是否含有氧元素,可以判断该物质是否属于氧化物 |
12.如表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准).
(1)下列化合物与氯化氢加成时,取代基对速率的影响与表中规律类似,其中反应速率最快的是A(填序号).
A.(CH3)2C=C(CH3)2 B.CH3CH=CHCH2CH3
C.CH2=CH CH3 D.CH2=CHCl
(2)烯烃与溴化氢、水加成时,产物有主次之分,例如:
CH2=CHCH3+HBr→CH3CHBrCH3+CH3CH2Br
(主要产物)(次要产物)
CH2=CHCH2CH3+H2O$\stackrel{H+}{→}$CH3CH(OH)CH2CH3+CH3CH2CH2CH2OH
(主要产物) (次要产物)
请写出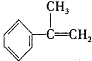 与HBr反应的主要产物的结构简式
与HBr反应的主要产物的结构简式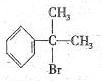 .
.
(3)禽流感在全球的蔓延,使人们谈“禽”色变.从香料八角中提取的莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一,达菲是抗禽流感病毒特效药物.
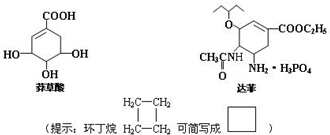
a.莽草酸分子中含有的官能团有羧基、羟基、碳碳双键;
b.莽草酸在浓硫酸作用下加热可以得到B(B的结构简式为: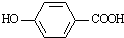 ),其反应类型为:消去反应;
),其反应类型为:消去反应;
c.请写出莽草酸与乙醇反应的化学方程式(有机物用结构简式表示):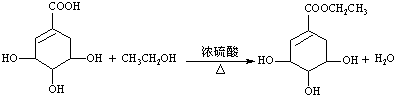 .
.
| 烯类化合物 | 相对速率 |
| (CH3)2C=CHCH3 | 10.4 |
| CH3CH=CH2 | 2.03 |
| CH2=CH2 | 1.00 |
| CH2=CHBr | 0.04 |
A.(CH3)2C=C(CH3)2 B.CH3CH=CHCH2CH3
C.CH2=CH CH3 D.CH2=CHCl
(2)烯烃与溴化氢、水加成时,产物有主次之分,例如:
CH2=CHCH3+HBr→CH3CHBrCH3+CH3CH2Br
(主要产物)(次要产物)
CH2=CHCH2CH3+H2O$\stackrel{H+}{→}$CH3CH(OH)CH2CH3+CH3CH2CH2CH2OH
(主要产物) (次要产物)
请写出
 与HBr反应的主要产物的结构简式
与HBr反应的主要产物的结构简式 .
.(3)禽流感在全球的蔓延,使人们谈“禽”色变.从香料八角中提取的莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一,达菲是抗禽流感病毒特效药物.

a.莽草酸分子中含有的官能团有羧基、羟基、碳碳双键;
b.莽草酸在浓硫酸作用下加热可以得到B(B的结构简式为:
 ),其反应类型为:消去反应;
),其反应类型为:消去反应;c.请写出莽草酸与乙醇反应的化学方程式(有机物用结构简式表示):
 .
.
13.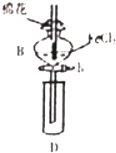 某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
I.先向B中的FeCl2溶液(约10ml)中通入Cl2,当B的溶液变黄时,停止通气
Ⅱ.打开活寒b,使约2ml的溶液流入D试管中,检验D溶液中的离子
Ⅲ.接着再向B中通入一定量的SO2气体
IV.更新试管D,重复过程Ⅱ,检验取出溶液中的离子
(1)仪器B的名称是分液漏斗,棉花中浸润的溶液为NaOH溶液的是吸收Cl2、SO2,防尾气污染环境
(2)实验室制备氯气的化学方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,反应中消耗4molHCl,转移的电子数是2NA
(3)过程Ⅲ中一定发生反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.过程ⅠV中检验取出溶液中足否含有硫酸根的操作是取溶液少许于试管中,先加入足量稀盐酸酸化,再滴加少量BaCl2溶液,若有白色沉淀生成,证明有SO42-,反之无
(4)甲、乙、丙三同学分别完成了上述实验,下表是他们的检测结果,其中一定能够证明SO、Fe2+和Cl-还原性强弱关系的是乙、丙:则SO2、Fe2+和Cl-还原性强弱顺序是SO2>Fe2+>Cl-
 某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:I.先向B中的FeCl2溶液(约10ml)中通入Cl2,当B的溶液变黄时,停止通气
Ⅱ.打开活寒b,使约2ml的溶液流入D试管中,检验D溶液中的离子
Ⅲ.接着再向B中通入一定量的SO2气体
IV.更新试管D,重复过程Ⅱ,检验取出溶液中的离子
(1)仪器B的名称是分液漏斗,棉花中浸润的溶液为NaOH溶液的是吸收Cl2、SO2,防尾气污染环境
(2)实验室制备氯气的化学方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,反应中消耗4molHCl,转移的电子数是2NA
(3)过程Ⅲ中一定发生反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.过程ⅠV中检验取出溶液中足否含有硫酸根的操作是取溶液少许于试管中,先加入足量稀盐酸酸化,再滴加少量BaCl2溶液,若有白色沉淀生成,证明有SO42-,反之无
(4)甲、乙、丙三同学分别完成了上述实验,下表是他们的检测结果,其中一定能够证明SO、Fe2+和Cl-还原性强弱关系的是乙、丙:则SO2、Fe2+和Cl-还原性强弱顺序是SO2>Fe2+>Cl-
| 过程Ⅱ中检出离子 | 过程ⅠV中检出离子 | |
| 甲 | 有 Fe3+无 Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有S042- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |