题目内容
根据如图所示,写出反应的热化学方程式,并回答问题.
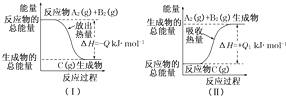
(1)反应过程(Ⅰ)的热化学方程式: .
(2)反应过程(Ⅱ)的热化学方程式: .
(3)Q与Q1的关系:Q Q1(填“大于”“小于”或“等于”)
(4)已知下列反应的反应热为:
①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H=-870.3kJ?mol-1
②C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
③H2(g)+
O2(g)═H2O(l)△H=-285.8kJ?mol-1,试计算下列反应的反应热:2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H= .

(1)反应过程(Ⅰ)的热化学方程式:
(2)反应过程(Ⅱ)的热化学方程式:
(3)Q与Q1的关系:Q
(4)已知下列反应的反应热为:
①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H=-870.3kJ?mol-1
②C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
③H2(g)+
| 1 |
| 2 |
考点:热化学方程式
专题:
分析:(1)依据图1分析可知反应物的总能量高于生成物的总能量,为放热反应,依据热化学方程式书写方法解答;
(2)依据图2分析可知反应物的总能量低于生成物的总能量,为吸热反应,依据热化学方程式书写方法解答;
(3)反应的焓变和反应物和生成物能量有关于变化过程无关,正反应和逆反应的焓变数值相同,符号相反;
(4)利用已知反应,据盖斯定律解答.
(2)依据图2分析可知反应物的总能量低于生成物的总能量,为吸热反应,依据热化学方程式书写方法解答;
(3)反应的焓变和反应物和生成物能量有关于变化过程无关,正反应和逆反应的焓变数值相同,符号相反;
(4)利用已知反应,据盖斯定律解答.
解答:
解:(1)由图1可知反应物AB的能量高于生成物C的能量,反应是放热反应,热化学方程式书为,A2(g)+B2(g)=C(g)△H=-QKJ/mol,
故答案为:A2(g)+B2(g)=C(g)△H=-QKJ/mol;
(2)由图2可知反应物C的能量低于生成物AB的能量,反应是吸热反应,热化学方程式为C(g)=A2(g)+B2(g)△H=+Q1KJ/mol,
故答案为:C(g)=A2(g)+B2(g)△H=+Q1KJ/mol;
(3)反应的焓变和反应物和生成物能量有关于变化过程无关,正反应和逆反应的焓变数值相同,符号相反,故答案为:等于;
(4)已知①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ?mol-1
②C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
③H2(g)+
O2(g)═H2O(l)△H=-285.8kJ?mol-1
据盖斯定律,②×2+③×2-①得:
2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H=-488.3KJ/mol,
故答案为:-488.3 kJ?mol-1.
故答案为:A2(g)+B2(g)=C(g)△H=-QKJ/mol;
(2)由图2可知反应物C的能量低于生成物AB的能量,反应是吸热反应,热化学方程式为C(g)=A2(g)+B2(g)△H=+Q1KJ/mol,
故答案为:C(g)=A2(g)+B2(g)△H=+Q1KJ/mol;
(3)反应的焓变和反应物和生成物能量有关于变化过程无关,正反应和逆反应的焓变数值相同,符号相反,故答案为:等于;
(4)已知①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ?mol-1
②C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
③H2(g)+
| 1 |
| 2 |
据盖斯定律,②×2+③×2-①得:
2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H=-488.3KJ/mol,
故答案为:-488.3 kJ?mol-1.
点评:本题考查了反应能量变化及其盖斯定律的应用,图象分析判断是解题关键,注意反应焓变只与始态和终态有关,与变化过程无关,题目较简单.

练习册系列答案
相关题目
如图所示装置中,a、b都是惰性电极,通电一段时间后,a极附近溶液呈红色.下列说法正确的是( )
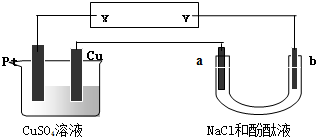

| A、NaCl溶液浓度不变 |
| B、X是负极,Y是正极 |
| C、CuSO4溶液浓度变小 |
| D、X是正极,Y是负极 |
氰气的化学式为(CN)2,它的性质和卤素相似,称为拟卤素,对其性质和有关化合物性质的叙述不正确的是( )
| A、AgCN难溶于水 |
| B、MnO2不能与HCN反应生成(CN)2 |
| C、HCN易形成白雾 |
| D、(CN)2和NaOH溶液反应生成NaCN、NaCNO和H2O |
湿润的蓝色石蕊试纸放入盛有Cl2的集气瓶中,对观察到的现象描述正确的是( )
| A、变红 | B、先变红后褪色 |
| C、变白 | D、不变色 |
 (1)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀.在空气酸度很小的环境中,该原电池的负极是
(1)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀.在空气酸度很小的环境中,该原电池的负极是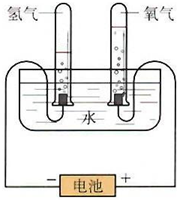 某学习小组根据图中所示的电解水原理进行实验,并对实验得到的与查阅资料获得的数据进行处理、分析,请与他们一起进行探究.请按要求填写.
某学习小组根据图中所示的电解水原理进行实验,并对实验得到的与查阅资料获得的数据进行处理、分析,请与他们一起进行探究.请按要求填写.