题目内容
17.用AlCl3溶液制备Al(OH)3沉淀,最好的方法是( )| A. | 加入适量HCl的溶液 | B. | 加入过量的氨水 | ||
| C. | 加入过量Ba(OH)2的溶液 | D. | 加入过量的NaOH溶液 |
分析 Al3+转化为不溶于水的物质是Al(OH)3,Al(OH)3具有两性,既能和酸反应又能和强碱反应,故用AlCl3制取Al(OH)3,选取试剂时不能选强碱,只能是弱碱.
解答 解:A、由于盐酸是强酸,氢氧化铝能溶解盐酸,故A错误;
B、一水合氨为弱碱,与氯化铝反应生成氢氧化铝沉淀,氢氧化铝不能溶于氨水,故B正确;
C、Ba(OH)2溶液是强碱溶液,沉淀Al3+时生成的氢氧化铝能溶解在过量的强碱溶液中,故C错误;
D、氢氧化钠溶液是强碱溶液,沉淀Al3+时生成的氢氧化铝能溶解在过量的强碱溶液中,故D错误;
故选B.
点评 本题以氢氧化铝的制备为载体,考查铝的重要化合物的性质,难度不大,注意题目要求意在考查氢氧化铝的两性这一特性.

练习册系列答案
相关题目
17.植物中山茶花,石榴可以吸收氯气,紫藤和月季对氯气的吸收净化能力也很强,在实验室制取Cl2时,尾气一般要沿NaOH溶液吸收而不用澄清石灰水吸收的理由是( )
| A. | 氯气不与石灰水反应 | |
| B. | Ca(OH)2能溶于水,澄清石灰水Ca(OH)2的含量少,吸收的尾气也很少 | |
| C. | 氯气与Ca(OH)2反应生成的CaCl2难溶于水 | |
| D. | 澄清石灰水能吸收空气中的CO2而边浑浊 |
8.固体A的化学式为NH5,它的所有原子的最外层均满足2个或8个电子的稳定结构.则下列有关说法中错误的是( )
| A. | 1mol NH5中含有5NA个N-H键(NA表示阿伏加德罗常数的值) | |
| B. | NH5中既有共价键又有离子键 | |
| C. | NH5的电子式为 | |
| D. | 它与水反应的化学方程式为NH5+H2O═NH3•H2O+H2↑ |
12.常温下,对下列电解质溶液的有关说法正确的是( )
| A. | 相同浓度和体积的强碱和强酸溶液混合后,溶液的pH一定等于7 | |
| B. | 在NaHCO3溶液中,c(CO32-)>c(HCO3-) | |
| C. | 在有AgCl沉淀的溶液中加入NaCl固体,c(Ag+)减小 | |
| D. | 将pH相等的CH3COONa和NaOH溶液稀释相同倍数,CH3COONa溶液的pH较小 |
2.在3Cl2+6KOH$\frac{\underline{\;\;△\;\;}}{\;}$KClO3+5KCl+3H2O的反应中,下列说法不正确的是( )
| A. | KCl是还原产物,KClO3是氧化产物 | |
| B. | KOH在该反应中体现碱性和还原性 | |
| C. | 反应中每消耗3 mol Cl2,转移电子数为5NA | |
| D. | 被还原的氯气的物质的量是被氧化的氯气的物质的量的5倍 |
9.下列反应的离子方程式正确的是( )
| A. | 钠投入到CuSO4溶液中:2Na+Cu2+═Cu↓+2Na+ | |
| B. | 澄清石灰水中加过量小苏打:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 氢氧化铝中滴入足量盐酸:Al(OH)3+3H+═Al3++3H2O | |
| D. | 四氧化三铁粉末投入到足量盐酸中:Fe3O4+8H+═3Fe3++4H2O |
6.下列操作中一定不会出现沉淀现象的是( )
| A. | CO2气体通入Na2SiO3溶液中 | B. | SO2气体通入Ca(OH)2溶液中 | ||
| C. | CO2气体通入饱和Na2CO3溶液中 | D. | SO2气体通入CaCl2溶液中 |
7.为了鉴定溴乙烷中溴元素的存在,以下各步实验:①加入AgNO3溶液 ②加入NaOH水溶液 ③加热 ④用HNO3酸化溶液 ⑤加入NaOH的醇溶液,其中操作顺序合理的是( )
| A. | ①②③⑤ | B. | ②③④① | C. | ④③⑤① | D. | ④②⑤③ |
 A、B、C、D、E各物质的转化关系如图所示.
A、B、C、D、E各物质的转化关系如图所示.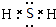 ;
; ;
;