题目内容
18.工业上以氯化钾和钛白厂的副产品硫酸亚铁为原料可得到硫酸钾、过二硫酸钠和铁红颜料等产品,该方法原料的综合利用率较高.
(1)基态钛原子的核外电子排布式为[Ar]3d24s2.H、N、O三种元素的电负性由大到小的顺序是O>N>H.
(2)TiCl4在常温下是一种无色液体,而FeCl3可用升华法提纯,则两种氯化物均属于分子晶体.
(3)KCl与MgO的晶体结构跟NaCl的晶体结构相似,则KCl与MgO两者中熔点高的是MgO,原因是Mg2+与O2-半径和小于K+与Cl-半径且MgO中阴阳离子所带电荷均比KCl中阴阳离子所带电荷多,故MgO晶格能比KCl大,熔点高.
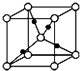
(4)在一定条件下铁形成的晶体的基本结构单元如图1和图2所示,则图1和图2的结构中铁原子的配位数之比为2:3.
(5)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是CrO2.
分析 (1)钛(Ti)是22号元素,原子核外电子数为22,根据核外电子排布规律书写;同一周期元素电负性从左到右递增;
(2)两种氯化物的熔沸点较低,应属于分子晶体;
(3)离子键越强,熔点越高,根据离子半径与离子所带电荷来分析;
(4)根据均摊法分别计算两种晶体的配位数,可计算出配位数之比.
(5)金属阳离子含未成对电子越多,则磁性越大,根据离子的最外层电子数判断未成对电子.
解答 解:(1)钛(Ti)是22号元素,原子核外电子数为22,核外电子排布为[Ar]3d24s2;同一周期元素电负性从左到右递增,H显正价,H的电负性最小,故电负性大小顺序是:O>N>H;
故答案为:[Ar]3d24s2;O>N>H;
(2)两种氯化物的熔沸点较低,应属于分子晶体,故答案为:分子;
(3)KCl晶体中钾离子、氯离子半径都大于镁离子、氧离子半径,镁离子、氧离子所带的电荷多,故MgO中离子键更强,故MgO的熔点更高;
故答案为:MgO;Mg2+与O2-半径和小于K+与Cl-半径且MgO中阴阳离子所带电荷均比KCl中阴阳离子所带电荷多,故MgO晶格能比KCl大,熔点高;
(4)图1中Fe位于体心和顶点,铁的配位数为8,图2中Fe位于顶点和面心,距离最近的为顶点和面心的铁原子,有12个,所以配位数为12,二者比值为8:12=2:3,
故答案为:2:3;
(5)V2O5中V的最外层电子全部失去或成键,CrO2中Cr失去4个电子,离子的最外层电子为2,未成对,离子含未成对电子越多,则磁性越大,则适合作录音带磁粉原料的是CrO2,
故答案为:CrO2.
点评 本题考查较为综合,涉及多方面的知识,难度中等,注意利用均摊法计算晶胞,学习中注意把握电子排布式、晶体的类型以及熔沸点的比较等方法.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
9.合成氨是人类科学技术发展史上的一项重大突破,其反应原理为:N2(g)+3H2(g)?2NH3(g)△H<0
回答下列问题:
(1)450℃时,往2L密闭容器中充人1molN2,和2.6molH2,反应过程中NH3的物质的量浓度随时间的变化情况如表所示:
 ①反应开始的5min内,生成NH3的平均反应速率为0.016mol/(L.min);平衡时H2的转化率为23.1%;该反应的平衡常数为0.1.
①反应开始的5min内,生成NH3的平均反应速率为0.016mol/(L.min);平衡时H2的转化率为23.1%;该反应的平衡常数为0.1.
②下列叙述中,能说明该合成氨反应已达到平衡的是BD(填字母代号)?
A.容器内的气体密度保持不变
B.容器内的气体压强保持不变
C.容器内N2、H2、NH3物质的量浓度之比为1:3:2
D.单位时间内消耗a molN2,同时生成3amolH2
③若再向平衡体系中充入l mol N2、2.5molH2、0.5mol NH3,平衡将正向移动(填“正向移动”、“逆向移动”或“不移动”).
(2)由图表示反应速率与反应过程的关系,当反应达到平衡后不断改变条件(不改变N2、H2、NH3的量,每次只改变一种条件),其中t1时刻改变的条件是升高温度,表示平衡混合物中NH3的含量最高的一段时间是t0~t1段
(3)一种合成氨的新方法为:在常压下,把氢气和用氦气稀释的氮气分别通入570℃的电解池,让氢离子通过的多孔陶瓷固体作电解质,氢气和氮气在电极上合成氨,氢气转化率达到78%,该电解池阴极的电极反应式为N2+6H++6e-═2NH3.
(4)25℃时,pH=a的氨水与pH=b)的盐酸等体积混合,恰好完全反应,则该温度下原氨水电离的百分数可表示为A.
A.10(a+b-12)% B.10(a+b-14)% C.10(12-a-b)% D.10(14-a-b)%
回答下列问题:
(1)450℃时,往2L密闭容器中充人1molN2,和2.6molH2,反应过程中NH3的物质的量浓度随时间的变化情况如表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/(mol•L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
 ①反应开始的5min内,生成NH3的平均反应速率为0.016mol/(L.min);平衡时H2的转化率为23.1%;该反应的平衡常数为0.1.
①反应开始的5min内,生成NH3的平均反应速率为0.016mol/(L.min);平衡时H2的转化率为23.1%;该反应的平衡常数为0.1.②下列叙述中,能说明该合成氨反应已达到平衡的是BD(填字母代号)?
A.容器内的气体密度保持不变
B.容器内的气体压强保持不变
C.容器内N2、H2、NH3物质的量浓度之比为1:3:2
D.单位时间内消耗a molN2,同时生成3amolH2
③若再向平衡体系中充入l mol N2、2.5molH2、0.5mol NH3,平衡将正向移动(填“正向移动”、“逆向移动”或“不移动”).
(2)由图表示反应速率与反应过程的关系,当反应达到平衡后不断改变条件(不改变N2、H2、NH3的量,每次只改变一种条件),其中t1时刻改变的条件是升高温度,表示平衡混合物中NH3的含量最高的一段时间是t0~t1段
(3)一种合成氨的新方法为:在常压下,把氢气和用氦气稀释的氮气分别通入570℃的电解池,让氢离子通过的多孔陶瓷固体作电解质,氢气和氮气在电极上合成氨,氢气转化率达到78%,该电解池阴极的电极反应式为N2+6H++6e-═2NH3.
(4)25℃时,pH=a的氨水与pH=b)的盐酸等体积混合,恰好完全反应,则该温度下原氨水电离的百分数可表示为A.
A.10(a+b-12)% B.10(a+b-14)% C.10(12-a-b)% D.10(14-a-b)%
13.某元素原子的电子排布式是1s22s22p63s23p4,则它在周期表中的位置是( )
| A. | 第2周期第ⅣA族 | B. | 第3周期第ⅣA族 | C. | 第4周期第ⅡA族 | D. | 第3周期第ⅥA族 |
3.常温下,下列各组微粒在指定的溶液中一定大量存在都是( )
| A. | NaAlO2溶液中:Cl-、HCO3-、K+、Ba2+ | |
| B. | FeCl3溶液中:K+、NH4+、Br-、SCN- | |
| C. | $\frac{c{(H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH4+、NO3-、K+、Cl- | |
| D. | KMnO4的溶液中:H+、SO42-、CH3CH2OH |
10.钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染.

请回答下列问题:
(1)Fe位于元素周期表中第四周期,第ⅤⅢ族.
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO.
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2•x H2O,再经焙烧制得.水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因:发生TiCl4+(2+x)H2O=TiO2•xH2O+4HCl,加入大量水并加热,HCl挥发,促使水解正向进行
(4)反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于1412℃即可.
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数为$\frac{cVM}{10w}$%.(用代数式表示)
(6)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g)?CH3OH(g).若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H25mol.

请回答下列问题:
(1)Fe位于元素周期表中第四周期,第ⅤⅢ族.
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO.
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2•x H2O,再经焙烧制得.水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因:发生TiCl4+(2+x)H2O=TiO2•xH2O+4HCl,加入大量水并加热,HCl挥发,促使水解正向进行
(4)反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于1412℃即可.
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
(6)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g)?CH3OH(g).若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H25mol.
7.生活处处有化学.下列说法正确的是( )
| A. | 糖类化合物都具有相同的官能团 | |
| B. | 煎炸食物的花生油和牛油都是可皂化的酯类 | |
| C. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
8. 室温下,用0.100mol•L-1NaOH溶液分别滴定20.00mL 0.100mol•L-1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
室温下,用0.100mol•L-1NaOH溶液分别滴定20.00mL 0.100mol•L-1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
 室温下,用0.100mol•L-1NaOH溶液分别滴定20.00mL 0.100mol•L-1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
室温下,用0.100mol•L-1NaOH溶液分别滴定20.00mL 0.100mol•L-1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )| A. | Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线 | |
| B. | V(NaOH)=10.00 mL时,QUOTE>1 | |
| C. | 当V(NaOH)=20.00 mL时,两种酸溶液的pH均等于7 | |
| D. | V(NaOH)=20.00 mL时,c(Cl-)<c(CH3COO-) |

 生物质能是一种洁净,可再生的能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.
生物质能是一种洁净,可再生的能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.