题目内容
12.在两个烧杯中分别盛有100mL 3.0mol•L-1的盐酸和氢氧化钠溶液,向两个烧杯中分别加入等质量的铝粉,在相同状况下生成的气体的体积比为2:5,则加入的铝粉的质量为( )| A. | 2.7 g | B. | 5.4 g | C. | 6.75 g | D. | 8.1 g |
分析 盐酸和氢氧化钠溶液中溶质的物质的量相同,加入铝的质量相同,若Al都完全反应,则生成氢气应相等,而应结束后测得生成的气体体积比为2:5,由方程式:2Al+6HCl═2AlCl3+3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑,可知酸与金属反应时酸不过量,碱与金属反应时碱过量,结合方程式计算解答.
解答 解:盐酸和氢氧化钠溶液中溶质的物质的量相同,加入铝的质量相同,若Al都完全反应,则生成氢气应相等,而应结束后测得生成的气体体积比为2:5,由方程式:2Al+6HCl═2AlCl3+3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑,可知酸与金属反应时酸不过量,碱与金属反应时碱过量.
盐酸和氢氧化钠溶液中溶质的物质的量均为0.1L×3mol/L=0.3mol,
设铝与酸反应时酸完全反应,生成的氢气的物质的量为x,则:
2Al+6HCl═2AlCl3+3H2↑
6 3
0.3mol x
解得x=$\frac{0.3mol×3}{6}$=0.15mol,
则碱与金属铝反应生成的氢气的物质的量为0.15mol×$\frac{5}{2}$=0.375mol,
碱与金属铝反应时铝完全反应,设与碱反应的铝的物质的量为y,则:
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
2 3
y 0.375mol
解得y=$\frac{0.375mol×2}{3}$=0.25mol,
则铝的质量为0.25mol×27g/mol=6.75g,
故选:C.
点评 本题考查化学反应方程式的计算,关键是判断反应中酸、碱是否足量,难度中等.

练习册系列答案
 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案
相关题目
2.青蒿酸(结构如图)具有致癌抗疟作用,下列有关它的叙述不正确的是( )
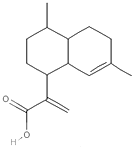

| A. | 能发生酯化反应 | B. | 属于芳香族化合物 | ||
| C. | 能与NaHCO3溶液反应 | D. | 能使溴的四氯化碳溶液褪色 |
20.实验室里需要450mL 0.1mol/L的氢氧化钠溶液,现选取500mL容量瓶进行配制,以下操作正确的是( )
| A. | 称取1.8g氢氧化钠固体,加入450mL水 | |
| B. | 称取1.8g氢氧化钠固体配成450mL溶液 | |
| C. | 称取2.0g氢氧化钠固体,加入500mL水 | |
| D. | 称取2.0g氢氧化钠固体配成500mL溶液 |
7.${\;}_{6}^{13}$C-NMR(核磁共振)可用于含碳化合物的结构分析.下列有关${\;}_{6}^{13}$C的说法正确的是( )
| A. | ${\;}_{6}^{13}$C的质量数是13,原子序数是6,核内有6个中子 | |
| B. | ${\;}_{6}^{13}$C与金刚石、石墨、C60等互为同素异形体 | |
| C. | ${\;}_{6}^{13}$C与${\;}_{6}^{12}$C是两种不同的碳元素 | |
| D. | ${\;}_{6}^{13}$C是碳的一种核素,与${\;}_{6}^{12}$C互为同位素 |
2.下列化学用语正确的是( )
| A. | 氯原子的结构示意图: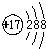 | |
| B. | 硫酸的电离方程式:H2SO4═H2++SO42- | |
| C. | 苏打粉的化学式:NaHCO3 | |
| D. | 明矾的化学式:KAl(SO4)2•12H2O |
 .
.