题目内容
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、1mol Fe与足量稀HNO3反应,转移2NA个电子 |
| B、1mol CnH2n含有的共用电子对的数目为(3n+1)NA |
| C、1mol CO2与1mol Na2O2完全反应时,转移的电子数目为NA |
| D、1mol?L-1的FeCl3溶液中,所含Fe3+的数目小于NA |
考点:阿伏加德罗常数
专题:
分析:A.Fe与足量稀HNO3反应,反应后铁元素表现+3价;
B.分子式为CnH2n的烃分子中,碳原子数为n,则烯烃或环烷烃中碳碳间共用电子对数为n-1+1=n,碳氢键为2n;
C.在 2Na2O2+2CO2═2Na2CO3+O2反应中,只有Na2O2中O元素的化合价发生变化,分别由-1价变化为0价和-2价;
D.体积未知,无法用n=cv求算;
B.分子式为CnH2n的烃分子中,碳原子数为n,则烯烃或环烷烃中碳碳间共用电子对数为n-1+1=n,碳氢键为2n;
C.在 2Na2O2+2CO2═2Na2CO3+O2反应中,只有Na2O2中O元素的化合价发生变化,分别由-1价变化为0价和-2价;
D.体积未知,无法用n=cv求算;
解答:
解:A.铁与稀硝酸反应方程式为Fe+4HNO3═3Fe(NO3)3+NO↑+2H2O,1mol Fe与足量稀HNO3反应,转移3NA个电子,故A错误;
B.1mol CnH2n含有的共用电子对的数目为3nNA,故B错误;
C.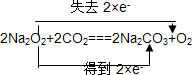 反应中Na2O2既是氧化剂又是还原剂,1mol CO2与1mol Na2O2完全反应时,转移的电子数目为NA,故C正确;
反应中Na2O2既是氧化剂又是还原剂,1mol CO2与1mol Na2O2完全反应时,转移的电子数目为NA,故C正确;
D.1mol?L-1的FeCl3溶液中,溶液体积未知,无法用n=cv判断所含Fe3+的数目,故D错误;
故选C.
B.1mol CnH2n含有的共用电子对的数目为3nNA,故B错误;
C.
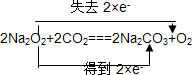 反应中Na2O2既是氧化剂又是还原剂,1mol CO2与1mol Na2O2完全反应时,转移的电子数目为NA,故C正确;
反应中Na2O2既是氧化剂又是还原剂,1mol CO2与1mol Na2O2完全反应时,转移的电子数目为NA,故C正确;D.1mol?L-1的FeCl3溶液中,溶液体积未知,无法用n=cv判断所含Fe3+的数目,故D错误;
故选C.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意物质的量、粒子数、化学键数、转移电子数等与阿伏加德罗常数关系.注意C选项转移的电子数目.

练习册系列答案
相关题目
已知NaHSO4在水中的电离方程式为:NaHSO4═Na++H++SO42-.某温度下,向c(H+)=1×10-6mol/L的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液中的c(H+)=1×10-2 mol/L.下列对该溶液的叙述错误的是( )
| A、该温度高于25℃ |
| B、由水电离出来的H+的浓度为1×10-10 mol/L |
| C、NaHSO4晶体的加入抑制了水的电离 |
| D、取该溶液加水稀释100倍,溶液中的c(OH-)减小 |
金属中熔点最低的是( )
| A、Fe | B、Hg | C、Sn | D、Na |
下列有关化学用语使用正确的是( )
A、NH4Br的电子式: | ||
B、S的结构示意图: | ||
| C、乙酸的分子式:CH3COOH | ||
D、原子核内有l8个中子的氯原子:
|
下列物质不能与乙酸反应的是( )
| A、镁 |
| B、CaCl2 |
| C、苛性钠 |
| D、小苏打 |
 锌铜原电池装置如图所示,常常采用电池图式表达式,如:
锌铜原电池装置如图所示,常常采用电池图式表达式,如:

 )转化为对甲基苯乙炔(
)转化为对甲基苯乙炔( )的一条合成路线如下:
)的一条合成路线如下: (G为相对分子质量为118的烃).
(G为相对分子质量为118的烃).