题目内容
7.在0.1mol•L-1的醋酸溶液中逐渐加入蒸馏水,随着水的加入,在一定时间内始终保增大趋势的是( )| A. | c(H+) | B. | c(CH3COO-) | ||
| C. | $\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的比值 | D. | $\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$的比值 |
分析 醋酸溶液中存在CH3COOH?CH3COO-+H+,加水稀释促进电离,n(CH3COO-)和n(H+)增大,n(CH3COOH)减小,结合溶液体积变化以及物质的量之比等于浓度之比解答该题.
解答 解:醋酸溶液中存在CH3COOH?CH3COO-+H+,加水稀释促进电离,
A.加水稀释,虽然n(H+)增大,但增大倍数明显小于体积增大倍数,则c(H+)减小,故A错误;
B.加水稀释,虽然n(CH3COO-)增大,但增大倍数明显小于体积增大倍数,则c(CH3COO-)减小,故B错误;
C.加水稀释促进电离,n(CH3COO-)和n(H+)增大,n(CH3COOH)减小,则$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{n({H}^{+})}{n(C{H}_{3}COOH)}$增大,故C正确;
D.由C分析可知,$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$减小,故D错误.
故选:C.
点评 本题考查弱电解质的电离,侧重于学生的分析能力的考查,注意把握弱电解质的电离特点以及影响因素,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.某元素X 的最高价含氧酸的化学式为HnXO2n-2,则其气态氢化物中的化学式为( )
| A. | H3n-12X | B. | H12-3n X | C. | H3n-4X | D. | H4-3nX |
19.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表,请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,C是否一定等于0.2否(选填“是”或“否”).混合液中离子浓度c(A-)与 c(Na+)的大小关系是c(A-)=c(Na+).
(2)不考虑其它组的实验结果,单从乙组情况分析,若a>7 (混合溶液的pH)来说明HA是强酸还是弱酸弱酸,理由是:若a>7,混合液显碱性,溶液中A-水解大于HA的电离,则HA是弱酸.
(3)丙组实验结果分析,HA是弱酸(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+).
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=10-5 mol•L-1.
| 实验编号 | HA物质的量浓度(mol•L-1) | NaOH物质的量浓度(mol•L-1) | 混合溶液的pH |
| 甲 | C | 0.2 | pH=7 |
| 乙 | 0.2 | 0.1 | pH=a |
| 丙 | 0.2 | 0.2 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
(2)不考虑其它组的实验结果,单从乙组情况分析,若a>7 (混合溶液的pH)来说明HA是强酸还是弱酸弱酸,理由是:若a>7,混合液显碱性,溶液中A-水解大于HA的电离,则HA是弱酸.
(3)丙组实验结果分析,HA是弱酸(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+).
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=10-5 mol•L-1.
16.如图曲线a和b是盐酸与氢氧化钠相互滴定的滴定曲线,下列叙述正确的是( )


| A. | 盐酸的物质的量浓度为1mol/L | |
| B. | P点时恰好完全反应,溶液呈中性 | |
| C. | 曲线a是盐酸滴定氢氧化钠的滴定曲线 | |
| D. | 酚酞不能用作本实验的指示剂 |
17.以下有关元素的说法正确的是( )
| A. | 第IA族元素铯的同位素137Cs比133Cs多4个质子 | |
| B. | 溴元素的原子序数与氯元素的原子序数差为8 | |
| C. | 卤素元素的阴离子由上到下还原性依次减弱 | |
| D. | 117号元素位于元素周期表中第七周期、第VIIA族 |

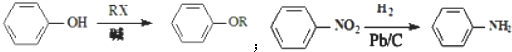

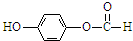 、
、 .
.
 ⑥
⑥ ⑦CH3CH2CH3
⑦CH3CH2CH3 ⑨
⑨ ⑩
⑩