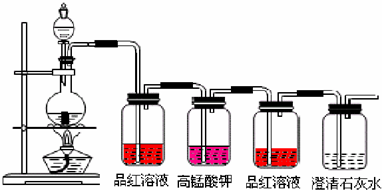
题目内容
(1)常温下,a mL 0.1mol?L-1的CH3COOH 与 bmL 0.1mol?L-1的NaOH混合,充份反应.
①写出反应的离子方程式:
②两溶液pH之和 14(填“<”“=”“>”).
③若a=b,则反应后溶液中粒子(除水分子外)浓度从大到小的顺序是 .
④若混合后溶液呈中性,则a b,反应后溶液中c(CH3COO-) c(Na+)(填“<”“=”“>”).
(2)常温下,a mL pH=3 CH3COOH 与 b mL pH=11的NaOH混合,充分反应.
①两溶液由水电离出的H+浓度之比为
②若a=b,则反应后溶液中粒子(除水分子外)浓度从大到小的顺序是 .
①写出反应的离子方程式:
②两溶液pH之和
③若a=b,则反应后溶液中粒子(除水分子外)浓度从大到小的顺序是
④若混合后溶液呈中性,则a
(2)常温下,a mL pH=3 CH3COOH 与 b mL pH=11的NaOH混合,充分反应.
①两溶液由水电离出的H+浓度之比为
②若a=b,则反应后溶液中粒子(除水分子外)浓度从大到小的顺序是
考点:酸碱混合时的定性判断及有关ph的计算,离子浓度大小的比较
专题:
分析:(1)①CH3COOH和NaOH溶液发生生成CH3COONa和水,弱电解质、气体、沉淀、络合物等写化学式,可溶性强电解质写离子;
②常温下,0.1mol/L的CH3COOHpH>1,0.1mol/L的NaOH溶液pH=13;
③若a=b,二者恰好反应生成CH3COONa,CH3COO-水解导致溶液呈碱性,则c(OH-)>c(H+),再根据电荷守恒判断c(CH3COO-)、c(Na+)相对大小,CH3COO-水解但程度较小;
④CH3COONa是强碱弱酸盐,其溶液呈碱性,要使CH3COOH和NaOH混合溶液呈中性,则CH3COOH的物质的量应该稍微大些;再根据电荷守恒判断c(CH3COO-)、c(Na+)相对大小;
(2)①酸或碱抑制水电离,如果酸中c(H+)等于碱中c(OH-),则酸或碱抑制水电离程度相等;
②常温下,pH=3的醋酸浓度大于pH=11的NaOH浓度,如果a=b,二者反应时醋酸有剩余,溶液呈酸性,再结合电荷守恒判断c(CH3COO-)、c(Na+).
②常温下,0.1mol/L的CH3COOHpH>1,0.1mol/L的NaOH溶液pH=13;
③若a=b,二者恰好反应生成CH3COONa,CH3COO-水解导致溶液呈碱性,则c(OH-)>c(H+),再根据电荷守恒判断c(CH3COO-)、c(Na+)相对大小,CH3COO-水解但程度较小;
④CH3COONa是强碱弱酸盐,其溶液呈碱性,要使CH3COOH和NaOH混合溶液呈中性,则CH3COOH的物质的量应该稍微大些;再根据电荷守恒判断c(CH3COO-)、c(Na+)相对大小;
(2)①酸或碱抑制水电离,如果酸中c(H+)等于碱中c(OH-),则酸或碱抑制水电离程度相等;
②常温下,pH=3的醋酸浓度大于pH=11的NaOH浓度,如果a=b,二者反应时醋酸有剩余,溶液呈酸性,再结合电荷守恒判断c(CH3COO-)、c(Na+).
解答:
解:(1)①CH3COOH和NaOH溶液发生生成CH3COONa和水,弱电解质、气体、沉淀、络合物等写化学式,可溶性强电解质写离子,所以离子方程式为CH3COOH+OH-=CH3COO-+H2O,故答案为:CH3COOH+OH-=CH3COO-+H2O;
②常温下,0.1mol/L的CH3COOHpH>1,0.1mol/L的NaOH溶液pH=13,所以两种溶液的pH之和>1+13=14,故答案为:>;
③若a=b,二者恰好反应生成CH3COONa,CH3COO-水解导致溶液呈碱性,则c(OH-)>c(H+),根据电荷守恒得c(CH3COO-)<c(Na+),CH3COO-水解但程度较小,但是CH3COO-水解程度大于水的电离,CH3COO-水解和水电离都生成OH-,所以该溶液中粒子(除水分子外)浓度大小顺序是c(Na+)>C(CH3COO-)>c(OH-)>C(CH3COOH)>c(H+),故答案为:c(Na+)>C(CH3COO-)>c(OH-)>c(CH3COOH)>c(H+);
④CH3COONa是强碱弱酸盐,其溶液呈碱性,要使CH3COOH和NaOH混合溶液呈中性,则CH3COOH的物质的量应该稍微大些,所以a>b;混合溶液呈中性,则c(OH-)=c(H+),根据电荷守恒得c(CH3COO-)=c(Na+),故答案为:>;=;
(2)①酸或碱抑制水电离,如果酸中c(H+)等于碱中c(OH-),则酸或碱抑制水电离程度相等,常温下,pH=3 CH3COOH溶液中c(H+)等于pH=11的NaOH中c(OH-)为0.01mol/L,所以二者抑制水电离程度相等,则两溶液由水电离出的H+浓度之比为1:1,故答案为:1:1;
②常温下,pH=3的醋酸浓度大于pH=11的NaOH浓度,如果a=b,二者反应时醋酸有剩余,溶液呈酸性,醋酸的电离程度很小,所以溶液中浓度最大的是CH3COOH,溶液呈酸性,则c(OH-)<c(H+),根据电荷守恒得c(CH3COO-)>c(Na+),溶液中CH3COO-抑制CH3COOH电离,所以反应后溶液中粒子(除水分子外)浓度从大到小的顺序是c(CH3COOH)>c(CH3COO-)>c(Na+)>c(H+)>c(OH-),
故答案为:c(CH3COOH)>c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
②常温下,0.1mol/L的CH3COOHpH>1,0.1mol/L的NaOH溶液pH=13,所以两种溶液的pH之和>1+13=14,故答案为:>;
③若a=b,二者恰好反应生成CH3COONa,CH3COO-水解导致溶液呈碱性,则c(OH-)>c(H+),根据电荷守恒得c(CH3COO-)<c(Na+),CH3COO-水解但程度较小,但是CH3COO-水解程度大于水的电离,CH3COO-水解和水电离都生成OH-,所以该溶液中粒子(除水分子外)浓度大小顺序是c(Na+)>C(CH3COO-)>c(OH-)>C(CH3COOH)>c(H+),故答案为:c(Na+)>C(CH3COO-)>c(OH-)>c(CH3COOH)>c(H+);
④CH3COONa是强碱弱酸盐,其溶液呈碱性,要使CH3COOH和NaOH混合溶液呈中性,则CH3COOH的物质的量应该稍微大些,所以a>b;混合溶液呈中性,则c(OH-)=c(H+),根据电荷守恒得c(CH3COO-)=c(Na+),故答案为:>;=;
(2)①酸或碱抑制水电离,如果酸中c(H+)等于碱中c(OH-),则酸或碱抑制水电离程度相等,常温下,pH=3 CH3COOH溶液中c(H+)等于pH=11的NaOH中c(OH-)为0.01mol/L,所以二者抑制水电离程度相等,则两溶液由水电离出的H+浓度之比为1:1,故答案为:1:1;
②常温下,pH=3的醋酸浓度大于pH=11的NaOH浓度,如果a=b,二者反应时醋酸有剩余,溶液呈酸性,醋酸的电离程度很小,所以溶液中浓度最大的是CH3COOH,溶液呈酸性,则c(OH-)<c(H+),根据电荷守恒得c(CH3COO-)>c(Na+),溶液中CH3COO-抑制CH3COOH电离,所以反应后溶液中粒子(除水分子外)浓度从大到小的顺序是c(CH3COOH)>c(CH3COO-)>c(Na+)>c(H+)>c(OH-),
故答案为:c(CH3COOH)>c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
点评:本题考查酸碱混合溶液定性判断及离子浓度大小比较,明确溶液中溶质及其性质、溶液酸碱性即可解答,难点是粒子浓度大小比较,要注意c(CH3COOH)大小判断,为易错点.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
向某CuSO4饱和溶液中加入含18O的无水CuSO4粉末xg,如温度不变,其结果是( )
| A、无水CuSO4不会溶解,xg粉末质量不变 |
| B、含18O的SO42-进入溶液,白色粉末变成蓝色晶体,其质量大于xg |
| C、含18O的SO42-进入溶液,白色粉末变成蓝色晶体,其质量等于xg |
| D、溶解平衡被破坏,达到新的平衡时有部分含18O的SO42-进入溶液,固体粉末小于xg |
关于 下列说法正确的是( )
下列说法正确的是( )
 下列说法正确的是( )
下列说法正确的是( )| A、其M电子层上的电子为8个 |
| B、该元素位于第三周期第ⅥA族 |
| C、最高正化合价为+2价 |
| D、该元素是长周期元素 |

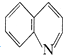 )是一种重要的有机化合物,其合成路线如下:
)是一种重要的有机化合物,其合成路线如下: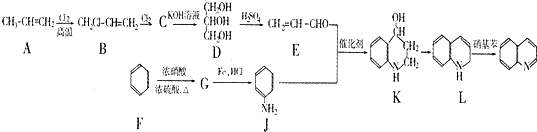
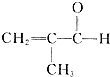 制备物质K的同系物:
制备物质K的同系物: