题目内容
19.请用适当的离子方程式解释下列现象:①NaHSO3溶液呈酸性HSO3-+H2O?H2SO3+OH-,HSO3-?SO32-+H+,电离大于水解
②NaAlO2溶液呈碱性AlO2-+2H2O=Al(OH)3+OH-
③明矾可用于净水:Al3++3H2O?Al(OH)3+3H+
④泡沫灭火器里盛有Al2(SO4)3溶液和NaHCO3溶液,当倒置灭火器时,两种溶液混合立即喷出大量泡沫Al3++3HCO3-=Al(OH)3↓+3CO2↑.
分析 ①亚硫酸氢钠溶液中,亚硫酸氢根离子的电离程度大于其水解程度,溶液呈酸性;
②偏铝酸根离子部分水解生成氢氧化铝和氢氧根离子,溶液呈碱性;
③明矾水解生成具有吸附性的氢氧化铝胶体;
④NaHCO3与Al2(SO4)3发生相互促进的水解反应生成二氧化碳和氢氧化铝.
解答 解:①NaHSO3溶液中存在反应:HSO3-+H2O?H2SO3+OH-、HSO3-?SO32-+H+,由于HSO3-的电离程度大于其水解程度,溶液呈酸性,
故答案为:HSO3-+H2O?H2SO3+OH-,HSO3-?SO32-+H+,电离大于水解;
②偏铝酸根离子在溶液中部分水解:AlO2-+2H2O=Al(OH)3+OH-,导致溶液呈碱性,
故答案为:AlO2-+2H2O=Al(OH)3+OH-;
③明矾水解生成具有吸附性的氢氧化铝胶体,反应的离子方程式为:Al3++3H2O?Al(OH)3+3H+,
故答案为:Al3++3H2O?Al(OH)3+3H+;
④NaHCO3与Al2(SO4)3发生相互促进的水解反应生成二氧化碳和氢氧化铝,其反应的离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑.
点评 本题考查盐类水解的应用,为高考常见题型,题目难度不大,注意把握盐类水解的规律以及影响因素,试题侧重基础知识的考查,有利于提高学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
10.以NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 32g O2所含的原子数目为2NA | |
| B. | 11.2L H2O含有的原子数目为1.5NA | |
| C. | 1mol的Cl-含NA个电子 | |
| D. | 0.5mol/L的NaCl溶液中Cl-的个数为是0.5NA |
7.关于生活中的化学知识,说法正确的是( )
| A. | 禁止使用含铅汽油,原因是铅资源短缺 | |
| B. | 增长汽车排气管的长度可以降低尾气中CO和NO的含量 | |
| C. | 目前国内销售的加碘食盐中,碘以KIO3的形式存在 | |
| D. | 光化学烟雾是大量排放SO2引起的 |
14.下列各组物质中所含原子数相同的是( )
| A. | 10gH2 和10gO2 | B. | 5.6LN2(标准状况)和11gCO2 | ||
| C. | 9gH2O和0.75molBr2 | D. | 224mL H2(标准状况)和0.1molN2 |
4.在pH=1的溶液中能大量共存的离子组是( )
| A. | NH4+、Mg2+、SO42-、Cl- | B. | Ba2+、K+、S2O32-、NO3- | ||
| C. | Al3+、Fe3+、SO42-、Cl- | D. | Na+、Ca2+、Cl-、AlO2- |
11.下列目的能达到的是( )
| A. | 将58.5 g NaCl溶于1 L 水中可得1 mol•L-1的NaCl溶液 | |
| B. | 将标准状况下22.4 L HCl溶于1 L 水中可得1 mol•L-1盐酸 | |
| C. | 将25.0 g胆矾溶于水后配成100 mL溶液所得溶液中溶质的物质的量浓度为1 mol•L-1 | |
| D. | 将78 g Na2O2溶于水,配成1 L溶液,其物质的量浓度为1 mol•L-1 |
6.下列反应中,属于取代反应的是( )
| A. | CH4+2O2$\stackrel{点燃}{→}$ CO2+2H2O | B. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | ||
| C. | CH4$\stackrel{高温}{→}$ C+2H2 | D. | 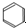 +HO-NO2$→_{△}^{浓硫酸}$H2O+ +HO-NO2$→_{△}^{浓硫酸}$H2O+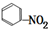 |
7.化学在工农业生产和日常生活中都有着重要的应用.下列叙述不正确的是( )
| A. | 长期使用(NH4)2SO4化肥会使土壤酸化,而过度使用尿素[CO(NH2)2]会使土壤碱化 | |
| B. | 锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去 | |
| C. | 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 | |
| D. | 神舟10号飞船所用太阳能电池板可将光能转换为电能,所用转换材料是SiO2 |