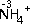题目内容
19.按下列要求各写出一个化学反应方程式:(1)有水生成的化合反应2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O
(2)生成一种碱性氧化物和一种酸性氧化物的分解反CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑.
分析 (1)化合反应为:两种或者两种物质生成一种物质的反应,例如:氢气与氧气反应生成水;
(2)分解反应为一种物质反应生成两种或者两种以上物质的反应,例如:碳酸钙高温反应生成氧化钙、二氧化碳,氧化钙为碱性氧化物,二氧化碳为酸性氧化物.
解答 解:(1)化合反应为:两种或者两种物质生成一种物质的反应,例如:氢气与氧气反应生成水,方程式:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O;
故答案为:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O;
(2)分解反应为一种物质反应生成两种或者两种以上物质的反应,例如:碳酸钙高温反应生成氧化钙、二氧化碳,氧化钙为碱性氧化物,二氧化碳为酸性氧化物,方程式:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;
故答案为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;
点评 本题考查了化学方程式的书写,明确化合反应、分解反应、酸性氧化物、碱性氧化物的概念是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列离子方程式正确的是( )
| A. | 铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 碳酸钠溶液与盐酸反应:Na2CO3+2H+═2Na++CO2↑+H2O | |
| C. | 向氯化铝溶液中加入过量氢氧化钠溶液:Al3++4OH-═AlO2-+2H2O | |
| D. | 稀硫酸和氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ |
7.分别依据下列实验事实,得出的结论正确的是( )
| 实验事实 | 结论 | |
| A | 将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色 | 随溶液pH减小,“84”消毒液的氧化能力增强 |
| B | 苯酚和水的浊液中,加碳酸钠溶液,溶液变澄清 | 苯酚的酸性比碳酸强 |
| C | 铜放入稀硫酸中,无明显现象,再加入硝酸钠固体,溶液变蓝,有明显的气泡放出,铜溶解 | 硝酸钠可以加快铜与稀硫酸的反应速率 |
| D | 向1 mL 0.1 mol/L的硝酸银溶液中加入1 mL0.1 mol/LNaCl溶液,出现白色沉淀,再加入几滴0.1 mol/L NaBr溶液,有淡黄色沉淀生成 | 氯化银的溶解度小于溴化银 |
| A. | A | B. | B | C. | C | D. | D |
14.下列叙述正确的为( )
| A. | 阿伏伽德罗常数就是6.02×1023 | |
| B. | 1mol任何物质都约含有6.02×1023分子 | |
| C. | 3.01×1023 个Na+的物质的量是0.5 mol | |
| D. | 2molSO42-约含1.204×1024 SO42- |
4.化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是( )
| A. | 检验溶液是否含有SO42-时,在无其他阳离子干扰的条件下,先用盐酸酸化,所得溶液再加BaCl2溶液 | |
| B. | 为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液酸化 | |
| C. | 检验溶液中是否含有Fe3+时,用硝酸酸化 | |
| D. | 定性检验SO32-,将BaCl2溶液用HNO3酸化 |
9.等物质的量的氢气和氦气在同温同压下具有相等的( )
| A. | 原子数 | B. | 体积 | C. | 中子数 | D. | 质量 |