题目内容
3.下列说法不正确的是( )| A. | 126C和146C是一种核素 | |
| B. | 红磷和白磷互为同素异形体 | |
| C. | CH3COOCH2CH3和CH3CH2COOCH3是不同物质 | |
| D. | CH3CH2OH可看成是由-C2H5和-OH两种基团组成 |
分析 A.具有一定数目质子和一定数目中子的一种原子叫做核素;
B.同种元素形成的结构不同的单质互称同素异形体;
C.CH3COOCH2CH3和CH3CH2COOCH3结构不同;
D.CH3CH2OH可看成是由-C2H5和-OH.
解答 解:A.126C和146C中子数不同,是不同种核素,故A错误;
B.红磷与白磷是磷元素形成的结构不同单质,互为同素异形体,故B正确;
C.CH3COOCH2CH3和CH3CH2COOCH3结构不同,是不同物质,故C正确;
D.CH3CH2OH可看成是由-C2H5和-OH两种基团组成,故D正确.
故选A.
点评 本题考查了核素、同分异构体、同素异形体的概念与区别以及有机物的结构等,难度不大,注意把握概念的内涵与外延.

练习册系列答案
相关题目
17.某常见有机物(分子内碳原子总数不超过10个)的结构简式可表示为 ,其核磁共振氢谱图中出现两组峰,且不同化学环境的氢原子数之比为3:2.下列关于该有机物的说法错误的是( )
,其核磁共振氢谱图中出现两组峰,且不同化学环境的氢原子数之比为3:2.下列关于该有机物的说法错误的是( )
 ,其核磁共振氢谱图中出现两组峰,且不同化学环境的氢原子数之比为3:2.下列关于该有机物的说法错误的是( )
,其核磁共振氢谱图中出现两组峰,且不同化学环境的氢原子数之比为3:2.下列关于该有机物的说法错误的是( )| A. | 该有机物燃烧时一定只生成CO2和H2O | |
| B. | 该有机物不可能为芳香醇 | |
| C. | 该有机物的分子式可能为C8H10O2 | |
| D. | 该有机物可能与NaOH溶液反应 |
14.已知反应:①Cl2+2KBr═2KCI+Br2 ②KClO3+6HCl═3Cl2+KCl+3H2O ③2KBrO3+Cl2=═Br2+2KClO3,下列说法正确的是( )
| A. | 上述三个反应都有单质生成.都属于置换反应 | |
| B. | 氧化性KClO>Br,还原性Br->CI- | |
| C. | 反应②中还原剂与氧化剂的物质的量之比为6:1 | |
| D. | ③中2mol还原剂反应则氧化剂得到电子的物质的量为2mol |
11.MnO2和锌是制造干电池的主要原料.电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液(主要含Mn2+)经净化后再进行电解,MnO2在电解池的阳极析出.90年代后期发明了生产MnO2和锌的新工艺,主要是采用软锰矿(主要成分为MnO2,含少量Al2O3和SiO2杂质)和闪锌矿(主要成分为ZnS,含少量FeS、CuS、CdS杂质)为主要原料,经过除杂后,得到含Zn2+、Mn2+离子的溶液,再通过电解同时获得MnO2和锌.简化流程框图如图(中间产物的固体部分已经略去):
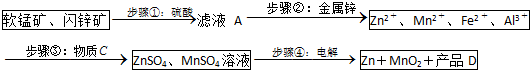
已知各种金属离子完全沉淀的pH如表:
回答下列问题:
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,请写出MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O、MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S↓+6H2O.
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成份为Cu、Cd(用化学符号表示)
(3)步骤③物质C由多种物质组成,其中含有两种固体,其中一种为MnO2,其作用是将Fe2+氧化为Fe3+,另外一种固体物质可为Zn(OH)2.
(4)步骤④中电解过程中MnO2在阳极析出,该电极上发生的反应方程式为Mn2+-2e-+2H2O=MnO2+4H+.产品D的化学式为H2SO4,该物质对整个生产的意义是溶解软锰矿、闪锌矿,可以循环利用.

已知各种金属离子完全沉淀的pH如表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,请写出MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O、MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S↓+6H2O.
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成份为Cu、Cd(用化学符号表示)
(3)步骤③物质C由多种物质组成,其中含有两种固体,其中一种为MnO2,其作用是将Fe2+氧化为Fe3+,另外一种固体物质可为Zn(OH)2.
(4)步骤④中电解过程中MnO2在阳极析出,该电极上发生的反应方程式为Mn2+-2e-+2H2O=MnO2+4H+.产品D的化学式为H2SO4,该物质对整个生产的意义是溶解软锰矿、闪锌矿,可以循环利用.
18.下列物质的水溶液因水解而呈碱性的是( )
| A. | NaCl | B. | NH4Cl | C. | Na2CO3 | D. | NaOH |
8.有关苯的结构和性质,下列说法正确的是( )
| A. |  与 与 是同分异构体 是同分异构体 | |
| B. | 苯在空气中不易燃烧完全,燃烧时冒浓烟 | |
| C. | 煤干馏得到的煤焦油可以分离出苯,苯是无色无味的液态烃 | |
| D. | 向2mL苯中加入1mL酸性高锰酸钾溶液,震荡后静置,可观察到液体分层,上层呈紫红色 |
15.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1molFeI2与1molCl2反应时转移的电子数为3NA | |
| B. | 2g H218O与D216O的混合物中所含中子、电子数目均为NA | |
| C. | 273K,101kPa下,28g乙烯与丙烯混合物中含有C-H键的数目为5NA | |
| D. | pH=1的H2SO4溶液10L,含H+的数目为2NA |
12.某有机物的结构简式如图所示,下列有关该有机物的说法中正确的是( )


| A. | 能和碳酸钠溶液反应的官能团有2种 | |
| B. | 1 mol该有机物最多能与2 mol H2发生加成 | |
| C. | 与  互为同分异构体 互为同分异构体 | |
| D. | 既可以发生取代反应又可以发生氧化反应 |
