题目内容
有一在空气中暴露过的KOH固体,经分析含H2O 2.8%,K2CO3 7.2%,取1g该样品投入25ml浓度为2mol/L的盐酸中,中和多余的盐酸又用去1.0mol/L的KOH溶液30.0ml,将中和后的溶液蒸干,所得固体的质量为 .
考点:有关混合物反应的计算
专题:守恒法
分析:K2CO3和KOH都能与盐酸反应生成KCl,过量盐酸再用KOH中和又生成KCl,反应后溶液中的溶质只有KCl,蒸干溶液得到固体产物为KCl,根据n=cV计算n(HCl),根据氯元素守恒n(KCl)=n(HCl),再根据m=nM计算KCl的质量.
解答:
解:K2CO3和KOH都能与盐酸反应生成KCl,过量盐酸再用KOH中和又生成KCl,反应后溶液中的溶质只有KCl,蒸干溶液得到固体产物为KCl,
根据氯元素守恒n(KCl)=n(HCl)=0.025L×2mol/L=0.05mol,
所以m(KCl)=0.05mol×74.5g/mol=3.725g
故答案为:3.725g.
根据氯元素守恒n(KCl)=n(HCl)=0.025L×2mol/L=0.05mol,
所以m(KCl)=0.05mol×74.5g/mol=3.725g
故答案为:3.725g.
点评:本题考查混合物的有关计算,关键清楚反应过程,利用原子守恒解答简化计算,注意守恒思想的运用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
用U形管做电解槽,惰性电极电解Na2CO3溶液,阳极和阴极所收集气体的体积比为(气体经干燥,并在同温同压下测量)( )
| A、1:2 | B、2:1 |
| C、略大于1:2 | D、略大于2:1 |
一定条件下存在反应:CO(g)+H2O(g)?CO2(g)+H2(g),其正反应放热.现有三个相同的2L恒温恒容密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1mol CO和1mol H2O,在Ⅱ中充入1mol CO2 和1mol H2,在Ⅲ中充入2mol CO 和2mol H2O,700℃条件下开始反应.达到平衡时,下列说法不正确的是( )
| A、容器Ⅰ、Ⅱ中正反应速率相同 |
| B、容器Ⅰ、Ⅲ中反应的平衡常数相同 |
| C、容器Ⅰ中CO 的转化率与容器Ⅱ中CO2 的转化率之和等于1 |
| D、容器Ⅰ中CO 的物质的量比容器Ⅱ中的多 |
研究有机物一般经过以下几个基本步骤:分离、提纯→确定实验式→确定分子式→确定结构式,以下用于研究有机物的方法错误的是( )
| A、蒸馏常用于分离提纯液态有机混合物 |
| B、核磁共振氢普通常用于分析有机物的相对分子质量 |
| C、燃烧法是研究确定有机物成分的有效方法 |
| D、对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团 |
经测定由甲醛(HCHO)和乙酸乙酯(C4H8O2)组成的混合物中氧的质量分数为16%,则此混合物中氢的质量分数是( )
| A、12% | B、78% |
| C、72% | D、13% |
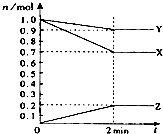 (1)某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示.由图中数据分析,该反应的化学方程式为:
(1)某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示.由图中数据分析,该反应的化学方程式为: 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应率的影响,在常温下按照如下方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应率的影响,在常温下按照如下方案完成实验.