题目内容
下列化学反应的离子方程式正确的是( )
| A、用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ |
| B、少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO |
| C、在稀氨水中通入过量CO2:NH3?H2O+CO2═NH4++HCO3- |
| D、氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42-═CaSO4↓+H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A、稀HNO3与FeS固体要发生氧化还原反应;
B、次氯酸具有极强的氧化性,不可能生成亚硫酸盐的;
C、一水合氨是弱电解质,应写成化学式,过量的二氧化碳生成碳酸氢盐;
D、钙离子和氢氧根离子要符合组成之比.
B、次氯酸具有极强的氧化性,不可能生成亚硫酸盐的;
C、一水合氨是弱电解质,应写成化学式,过量的二氧化碳生成碳酸氢盐;
D、钙离子和氢氧根离子要符合组成之比.
解答:
解:A、稀HNO3与FeS固体要发生氧化还原反应,正确的离子方程式为FeS+4H++NO3-═Fe3++S↓+NO↑+2H2O,故A错误;
B、酸具有极强的氧化性,不可能生成亚硫酸盐的,正确的离子方程式为Ca2++SO2(少量)+2ClO-+H2O=CaSO4↓+Cl-+HClO,故B错误;
C、一水合氨是弱电解质,应写成化学式,过量的二氧化碳生成碳酸氢盐,离子方程式为NH3?H2O+CO2═NH4++HCO3-,故C正确;
D、钙离子和氢氧根离子要符合组成之比,正确的离子方程式为Ca2++2OH-+2H++SO42-═CaSO4↓+2H2O,故D错误;
故选C.
B、酸具有极强的氧化性,不可能生成亚硫酸盐的,正确的离子方程式为Ca2++SO2(少量)+2ClO-+H2O=CaSO4↓+Cl-+HClO,故B错误;
C、一水合氨是弱电解质,应写成化学式,过量的二氧化碳生成碳酸氢盐,离子方程式为NH3?H2O+CO2═NH4++HCO3-,故C正确;
D、钙离子和氢氧根离子要符合组成之比,正确的离子方程式为Ca2++2OH-+2H++SO42-═CaSO4↓+2H2O,故D错误;
故选C.
点评:本题考查离子方程式的书写,题目难度不大,注意从化学式、离子符号、电荷守恒以及是否符合反应实际的角度分析.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
把①蔗糖 ②麦芽糖 ③淀粉 ④纤维素 ⑤油脂 ⑥酶 ⑦蛋白质,在酸存在的条件下分别进行水解,其水解的最终产物只有1种的有( )
| A、①②③④⑤ | B、②③④ |
| C、④⑥⑦ | D、③④⑤⑥⑦ |
下列措施对增大反应速率明显有效的是( )
| A、Na与水反应时增大水的用量 | |||
| B、Fe与稀硫酸反应制取氢气时,改用浓硫酸 | |||
| C、在H2SO4与Na2CO3两溶液反应时,增大压强 | |||
D、反应N2+3H2
|
 丹参素能明显抑制血小板的聚集,其结构如图所示,下列说法错误的是( )
丹参素能明显抑制血小板的聚集,其结构如图所示,下列说法错误的是( )| A、丹参素的分子式为C9H10O5 |
| B、丹参素能发生缩聚、消去、氧化反应 |
| C、1 mol丹参素最多可以和3mol H2发生加成反应 |
| D、1 mol丹参素与足量Na2CO3发生反应最多可生成二氧化碳1.5mol |
下列分子中含有两个π键的是( )
| A、O2 |
| B、N2 |
| C、H2O |
| D、C2H4 |
下列对各组元素性质递变情况描述错误的是( )
| A、Li、Be、B原子最外层电子数依次增多 |
| B、P、S、Cl元素最高正价依次升高 |
| C、N、O、F元素最高正价依次升高 |
| D、Na、K、Rb的最外层电子数相同 |
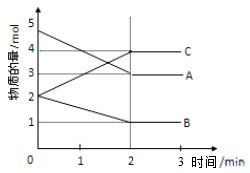 某温度时,在一恒容密闭容器中,A、B、C三种物质的物质的量n(mol)随时间t(min)变化的曲线如图所示,从图中的数据分析:
某温度时,在一恒容密闭容器中,A、B、C三种物质的物质的量n(mol)随时间t(min)变化的曲线如图所示,从图中的数据分析: