题目内容
9.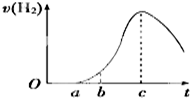 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示.
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示.请回答下列问题:
(1)曲线由O→a段不产生氢气的原因是氧化铝与硫酸反应生成硫酸铝和水,有关反应的离子方程式为Al2O3+6H+=2Al3++3H2O;
(2)曲线b→c段,产生氢气的速率增加较快的主要原因是反应放热使溶液温度升高;
(3)曲线由c以后,产生氢气的速率逐渐下降的主要原因是溶液中的氢离子浓度降低;
(4)该反应若使用催化剂,可使H2产量增多吗?不会(填“会”或“不会”).
(5)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为B.
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片 D.铜片、铜片.
分析 由图可知,开始不生成氢气,为氧化铝与硫酸的反应,然后Al与硫酸反应生成氢气,开始温度较低,由于反应放热,则温度升高反应速率加快,后来,氢离子浓度减小,则反应速率减小,以此来解答.
解答 解:(1)曲线由0→a段不产生氢气是因氧化铝与硫酸反应生成硫酸铝和水,离子反应为Al2O3+6H+=2Al3++3H2O,
故答案为:氧化铝与硫酸反应生成硫酸铝和水;Al2O3+6H+=2Al3++3H2O;
(2)线由b→c段,产生氢气的速率增加较快的主要原因为该反应为放热反应,温度升高,反应速率加快,故答案为:反应放热使溶液温度升高;
(3)曲线由c以后,产生氢气的速率逐渐下降的主要原因为氢离子浓度减小,反应速率减小,故答案为:溶液中的氢离子浓度降低;
(4)催化剂加快反应速率,不影响氢气的产量,故答案为:不会;
(5)将铝片和铜片用导线相连,一组插入浓硝酸中,铝钝化,所以Cu失电子作负极,一组插入烧碱溶液中,Cu与氢氧化钠不反应,Al失电子作负极,
碱性条件下,Al失电子生成偏铝酸根离子,其电极反应为:Al+4OH--3e-=AlO2-+2H2O;
故答案为:B.
点评 本题考查Al的化学性质及影响反应速率的因素,为高频考点,把握温度、浓度对反应速率的影响及氧化铝、Al与酸的反应为解答的关键,侧重分析能力的考查,题目难度不大.

练习册系列答案
相关题目
5.下列说法正确的是( )
| A. | 在合成氨工业中,移走NH3可增大正反应速率,提高原料转化率 | |
| B. | 锅炉中沉积的CaSO4可用饱和碳酸钠溶液浸泡,再用盐酸溶解而除去 | |
| C. | 将AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3 | |
| D. | 加热Fe2(SO4)3溶液,Fe3+的水解程度和溶液的pH均增大 |
6.化学与生产、生活密切相关,下列叙述正确的是( )
| A. | 六水氯化钙属于混合物 | B. | 葡萄糖注射液不能产生丁达尔效应 | ||
| C. | 食盐水属于浊液 | D. | 氯化铵不属于盐类 |
17.X、Y是短周期元素,两者组成化学式为X2Y2的化合物,已知X的原子序数为n,则Y的原子序数可能是( )
(1)n+3(2)n-3(3)n+5(4)n-5(5)n+11.
(1)n+3(2)n-3(3)n+5(4)n-5(5)n+11.
| A. | (1)(2)(3) | B. | (2)(4) | C. | (1)(4)(5) | D. | 全部 |
4.下列有关有机物的说法中正确的是( )
| A. | 凡是含有碳元素的化合物都属于有机物 | |
| B. | 大多数有机物都是由分子构成的 | |
| C. | 有机物都很容易燃烧 | |
| D. | 易溶于汽油、酒精、苯等有机溶剂中的物质,一定是有机物 |
1.下列能量转化过程中,由光能转变为化学能的是( )
| A. |  光伏发电 | B. |  风力发电 | C. |  光合作用 | D. |  电解制钠 |
19.人造地球卫星用到的一种高能电池-银锌电池,它在放电时的电极反应为:Zn+2OH--2e-═ZnO+H2O,Ag2O+H2O+2e-═2Ag+2OH-.据此判断,氧化银是( )
| A. | 负极,被氧化 | B. | 负极,被还原 | C. | 正极,被还原 | D. | 正极,被氧化 |