��Ŀ����
19��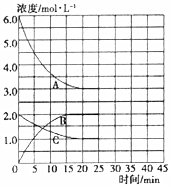 �����£�N2H4���ǵ������ֳ���������ڿ�ѧ�������������й㷺Ӧ�ã��ش��������⣺
�����£�N2H4���ǵ������ֳ���������ڿ�ѧ�������������й㷺Ӧ�ã��ش��������⣺��l����֪��N2��g��+3H2��g��?2NH3��g����H=-92.4kJ•mol-1
�ں��¡����ݵ��ܱ������У��ϳɰ���Ӧ�ĸ�����Ũ�ȵı仯������ͼ��ʾ��
�ټ����ڸ��¶��·�Ӧ2NH3��g��?N2��g��+3H2��g����ƽ�ⳣ��K=6.75��
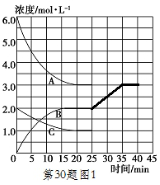
���ڵ�25minĩ�����������������䣬�����¶Ƚ��ͣ��ڵ�35minĩ�ٴδﵽƽ�⣮��ƽ���ƶ�������N2Ũ�ȱ仯��0.5mol/L������ͼ�л���25-40minNH3Ũ�ȱ仯���ߣ�
����֪��2N2��g��+6H2O��l��?4NH3��g��+3O2��g����H=+1530.0KJ/mol����������ȼ����Ϊ-285.8KJ/mol��
��2����N2H4��һ�ָ���ȼ�Ͼ��л�ԭ�ԣ�ͨ����NaClO�����NH3��Ӧ�Ƶã������Ϊʲô�ù���������Ӧ��ԭ������NaClO���ܽ�N2H4����ΪN2��
����NaClO��NH3 ��N2H4�ķ�Ӧ���൱���ӵģ���Ҫ��Ϊ������
��֪��һ����NH3+ClO-�TOH-+NH2Cl
��д���ڶ������ӷ���ʽNH3+NH2Cl+OH-=N2H4+Cl-+H2O��
��N2H4������ˮ�����백�����Ƶ������֪�䳣���µ��볣��K1=1.0��10-6�������£���0.2mol/L N2H4•H2O��0��lmol/L������������ϣ���������仯�������ʱ��Һ��PH����8 ������N2H4�Ķ������룩��
���� ��1������ͼ��֪��AΪ������CΪ������BΪ������ƽ��ʱ����ֵ�ƽ��Ũ�ȣ�c��H2��=3mol/L��c��N2��=1mol/L��c��NH3��=2mol/L������ƽ�ⳣ������ʽ���㣻
�ڽ����¶ȣ�ƽ������ȷ�Ӧ�����ƶ���Ҳ������ƽ������Ũ������ķ����ƶ���ƽ���ƶ�������N2Ũ�ȱ仯��0.5mol/L������Ũ�ȱ仯1mol/L���ɴ�����ͼ��
�۽���Ȼ�ѧ����ʽ��˹���ɼ���õ������Ȼ�ѧ����ʽ��
��2����NaClO��Һ��NH3����������ԭ��Ӧ�����Ȼ��ƺ��£��������ƾ���ǿ�����ԣ�N2H4��һ�ָ���ȼ�Ͼ��л�ԭ�Է�����
�ڴ������Ʊ��������������Ȼ��ƣ����������������£�ͬʱ����ˮ���ɣ���Ϸ�Ӧ��ѧ����ʽ������Ӧ���̣�
�۽�0.2mol/L N2H4•H2O��Һ��0.1mol/L HCl��Һ�������ϣ��õ�������N2H4•H2O��N2H5C1��Ũ��Ϊ0.05mol/L��ƽ�ⳣ�������¶ȱ仯�����ƽ�ⳣ�����㣮
��� �⣺��1������ͼ��֪��AΪ������CΪ������BΪ������ƽ��ʱ����ֵ�ƽ��Ũ�ȣ�c��H2��=3mol/L��c��N2��=1mol/L��c��NH3��=2mol/L�����¶��·�Ӧ2NH3��g��?N2��g��+3H2��g����ƽ�ⳣ��K=$\frac{{3}^{3}��1}{{2}^{2}}$=6.75��
�ʴ�Ϊ��6.75��
�ڽ����¶ȣ�ƽ������ȷ�Ӧ�����ƶ���Ҳ������ƽ������Ũ������ķ����ƶ���ƽ���ƶ�������N2Ũ�ȱ仯��0.5mol/L������Ũ�ȱ仯1mol/L���ɴ�����ͼ��Ϊ��
�� ��
��
�ʴ�Ϊ�� ��
��
�ۢ�N2��g��+3H2��g��?2NH3��g����H=-92.4kJ•mol-1
��.2N2��g��+6H2O��l��?4NH3��g��+3O2��g����H=+1530.0KJ/mol��
��˹���ɼ��㣨���2-��$\frac{1}{6}$�õ�H2��g��+$\frac{1}{2}$O2��g��=H2O��l������H=-285.8KJ/mol��
�ʴ�Ϊ��-285.8KJ/mol��
��2����N2H4��һ�ָ���ȼ�Ͼ��л�ԭ�ԣ�ͨ����NaClO�����NH3��Ӧ�Ƶã��÷�Ӧ�У��������Ʊ��������������Ȼ��ƣ����������������£�ͬʱ����ˮ���ɣ����Ը÷�Ӧ����ʽΪ��NaClO+2NH3=N2H4+NaCl+H2O���������ƹ���������N2H4���ɵ�����
�ʴ�Ϊ��������NaClO���ܽ�N2H4����ΪN2��
�ڸ÷�Ӧ�У��������Ʊ��������������Ȼ��ƣ����������������£�ͬʱ����ˮ���ɣ����Ը÷�Ӧ����ʽΪ��NaClO+2NH3=N2H4+NaCl+H2O����֪��һ����NH3+ClO-�TOH-+NH2Cl���ڶ������ӷ���ʽNH3+NH2Cl+OH-=N2H4+Cl-+H2O��
�ʴ�Ϊ��NH3+NH2Cl+OH-=N2H4+Cl-+H2O��
��N2H4������ˮ�����백�����Ƶ�������뷽��ʽΪ��N2H4+H2O?N2H5++OH-����֪�䳣���µ��볣��K1=1.0��10-6�������£���0.2mol/L N2H4•H2O��0��lmol/L������������ϣ���������仯�����õ�������N2H4•H2O��N2H5C1��Ũ��Ϊ0.05mol/L��
ƽ�ⳣ��K=$\frac{c��O{H}^{-}��c��{N}_{2}{{H}_{5}}^{+}��}{c��{N}_{2}{H}_{4}��}$=1.0��10-6��c��OH-��=10-6mol/L��c��H+��=$\frac{1{0}^{-14}}{1{0}^{-6}}$=10-8mol/L��
���ʱ��Һ��PH����8��
�ʴ�Ϊ��8��
���� ���⿼����ۺϣ��漰֪ʶ��϶࣬ע��ͨ��ͼ�������ѧ��Ӧ���ʡ���ѧƽ�⼰�������⣬��Ҫѧ����ǿ�Ĺ۲�������˼ά��������Ŀ�Ѷ��еȣ�

 ���ʿ��ÿ��ֳɳ�ϵ�д�
���ʿ��ÿ��ֳɳ�ϵ�д�| A�� | ��Һ��$\frac{c��M{g}^{2+}��}{c��M{n}^{2+}��}$=$\frac{1}{100}$ | |
| B�� | ����������NaOH��Ksp[Mg��OH��2]��Ksp[Mn��OH��2]����С | |
| C�� | ����������MgCl2����Һ��c��Mg2+����c��Mn2+�������� | |
| D�� | �������¶ȣ�Mg��OH��2��Mn��OH��2���ֹ�������������� |
| ѡ�� | Ӧ�� | ���� |
| A | �ý��ݹ����������Һ�Ĺ���������ˮ�� | ������������ˮ���ͷų�����ϩ |
| B | ���뺣�ڵĸ���բ����װһ��������п���ֹբ�ű���ʴ | ������ӵ����������������������� |
| C | ��������������Ͻ���� | ������������Ӧ |
| D | �ߴ����������оƬ�IJ��� | �辧������Ȼ�������ȶ����� |
| A�� | A | B�� | B | C�� | C | D�� | D |
| X | Y | Z |
| W |
| A�� | ZԪ�صij������ϼ�Ϊ��-1��-2 | |
| B�� | XԪ�ص��⻯��ķе�һ����Z�ĵ� | |
| C�� | Y��Z��W�γɵļ������У��뾶��С����Z | |
| D�� | ZԪ�صĵ����ܴ�Na2W��Һ���û���W�ĵ��� |
| A�� | 12gNaHSO4������������������ĿΪ0.2NA | |
| B�� | 23g������������O2��Ӧʱ��ת�Ƶ�����Ŀһ��ΪNA | |
| C�� | 1L 0.1mol/L��NaHCO3��Һ�У�HCO3-��CO32-������֮��Ϊ0.1NA | |
| D�� | ��״���£�11.2L CCl4�к���C-Cl������ĿΪ2NA |
| A�� | 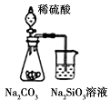 ��װ�ÿ�֤���ǽ�����ǿ����S��C��Si | |
| B�� | 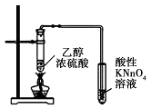 ��װ�ÿ����ڼ�������ϩ���� | |
| C�� |  ��װ�ÿ�ͨ������AlCl3������Һ�Ʊ�AlCl3���� | |
| D�� |  ��װ�ÿ������ⶨ�к��� |
| A�� | �轺������ʳƷ�Ŀ������� | |
| B�� | �����ȼ�ˮ��ϴ�����ϵ����� | |
| C�� | �������п����ǿ�俹��ʴ�� | |
| D�� | ����ȼ�ջ�ʯȼ���ǵ���������������Ҫ����֮һ |
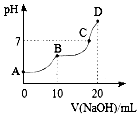 25��ʱ����10mL 0.1mol•L-1 H2A��Һ�еμӵ�Ũ�ȵ�NaOH��Һ����Һ��pH��NaOH��Һ�������ϵ��ͼ��ʾ����������������ǣ�������
25��ʱ����10mL 0.1mol•L-1 H2A��Һ�еμӵ�Ũ�ȵ�NaOH��Һ����Һ��pH��NaOH��Һ�������ϵ��ͼ��ʾ����������������ǣ�������| A�� | C����Һ�к���NaHA��Na2A | |
| B�� | NaHA��Һ��ˮ�ĵ���̶ȱ�Na2A��Һ��С | |
| C�� | B�㣬c ��Na+��=2[c ��H2A��+c ��HA��+c ��A2-��] | |
| D�� | D�㣬c ��Na+����c ��A2-����c ��OH-����c ��HA-����c ��H+�� |