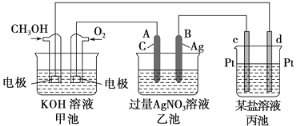
题目内容
【题目】电化学是研究化学能与电能相互转化的装置、过程和效率的科学。下列说法不正确的是
A.铅蓄电池放电时,正极的质量会变小
B.对于某耗氧燃料电池,无论负极通入何种燃料,若转移电子总数相等,则正极消耗等质量的氧气
C.可以通过适当的电解装置实现反应![]()
D.电解精炼铜,阳极为粗铜,电镀铜,阳极为纯铜
【答案】A
【解析】
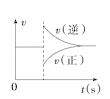
![]() 铅蓄电池在放电过程中,正极发生
铅蓄电池在放电过程中,正极发生![]() ,正极质量增大,故A错误;
,正极质量增大,故A错误;
B. 耗氧燃料电池,正极上氧气得电子生成水或氢氧根离子,O元素化合价由0价都降低到![]() 价,若转移电子总数相等,则正极消耗等质量的氧气,故B正确;
价,若转移电子总数相等,则正极消耗等质量的氧气,故B正确;
C.银为阳极,电解质溶液为稀硫酸,可实现反应![]() ,故C正确;
,故C正确;
D.电解精炼铜,粗铜作阳极、精铜作阴极;电镀铜,镀件作阴极、纯铜为阳极,故D正确;
故选A。

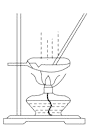
【题目】某化学兴趣小组设计如下实验方案,将浓硫酸与铜片反应制备SO2并进行相关实验探究,实验装置如图所示:
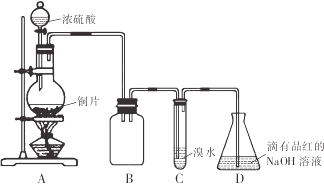
请回答下列问题:
(1)装置B的作用是______。
(2)设计装置C的目的是验证SO2的______性,装置C中发生反应的离子方程式是______装置D中NaOH全部转化为NaHSO3的标志是______。
(3)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能的情况:
I.HSO3-与ClO-恰好反应
Ⅱ.NaClO不足
Ⅲ.NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请完成下表:(已知酸性:H2SO3>H2CO3>HClO)
序号 | 实验操作 | 现象 | 结论 |
① | 加几小块CaCO3固体 | 有气泡产生 | I或Ⅱ |
② | 滴加少量淀粉KI溶液,振荡 | _______ | Ⅲ |
③ | 滴加少量溴水,振荡 | _________ | Ⅱ |
④ | 滴加少量酸性KMnO4溶液、振荡 | 溶液为紫色 | ____ |
(4)请设计简单实验证明:室温下HSO3-的电离平衡常数Ka与水解平衡常数Kb,的相对大小:___。