题目内容
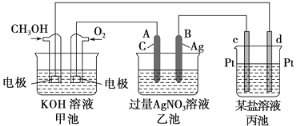
【题目】如图是一个化学过程的示意图。
请回答:
(1)甲池是________池,通入O2的一极电极反应式为__________________,该电池的总反应方程式为______________。
(2)乙池中A电极名称为________极,电极反应式为__________________。一段时间后溶液的pH________(填“增大”、“减小”或“不变”)。
(3)当乙池中B(Ag)极的质量增加5.40 g时,甲池中理论上消耗O2________mL(标准状况下)。
【答案】原电 O2+2H2O+4e-===4OH- 2CH3OH+3O2+4KOH===2K2CO3+6H2O 阳 4OH--4e-===O2↑+2H2O 减小 280
【解析】
由总方程式可知,甲醇被氧化,为原电池的负极,电极的电极反应式是CH3OH-6e-+8OH-═6H2O+CO32-,通入氧气的以及为原电池的正极,发生还原反应,电极方程式为O2+2H2O+4e-═4OH-,A与原电池正极相连,为电解池的阳极,则B为阴极,c为阳极,d为阴极,结合电解质溶液以及题目要求解答该题。
(1)甲为原电池,通入氧气的一极为原电池的正极,发生还原反应,电极方程式为O2+2H2O+4e-═4OH-,燃料电池的总反应式为2CH3OH+3O2+4KOH===2K2CO3+6H2O;
(2)乙为电解池,A与原电池正极相连,为电解池的阳极,发生氧化反应,电极方程式为4OH--4e-═O2↑+2H2O,电解硝酸银溶液,阳极生成氧气,阴极生成银,电解总反应式为4Ag++2H2O![]() 4Ag+O2↑+4H+,生成H+,则溶液pH减小;
4Ag+O2↑+4H+,生成H+,则溶液pH减小;
(3)乙池中B极发生还原反应,电极方程式为Ag++e-=Ag,n(Ag)=![]() =0.05mol,则转移电子0.05mol,由电极方程式O2+2H2O+4e-═4OH-可知消耗
=0.05mol,则转移电子0.05mol,由电极方程式O2+2H2O+4e-═4OH-可知消耗![]() =0.0125mol氧气,则V(O2)=0.0125mol×22.4L/mol=0.28L=280mL。
=0.0125mol氧气,则V(O2)=0.0125mol×22.4L/mol=0.28L=280mL。

【题目】下列用来解释实验事实的相关平衡方程式不正确的是
实验事实 | 相关平衡 | |
A | 加入NaHCO3使氯水的漂白能力增强 | Cl2+H2O |
B | 配制FeCl3溶液时加少量盐酸 | Fe3++3OH- |
C | 溶有CO2的正常雨水pH≈5.6 | H2O+CO2 |
D | CaCO3固体溶于盐酸 | CaCO3(s) |
A. A B. B C. C D. D