题目内容
【题目】下列各图与表述一致的是
A.图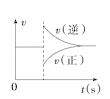 可以表示对某化学平衡体系改变温度后反应速率随时间的变化
可以表示对某化学平衡体系改变温度后反应速率随时间的变化
B.用图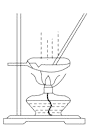 所示装置蒸发AlCl3溶液制备无水AlCl3
所示装置蒸发AlCl3溶液制备无水AlCl3
C.图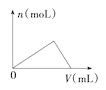 可以表示向一定量的明矾溶液中逐滴滴加一定浓度氢氧化钡溶液时产生Al(OH)3沉淀的物质的量变化
可以表示向一定量的明矾溶液中逐滴滴加一定浓度氢氧化钡溶液时产生Al(OH)3沉淀的物质的量变化
D.图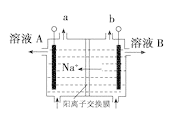 电解饱和食盐水的装置中,溶液A、B中由水电离出的c(H+):A>B
电解饱和食盐水的装置中,溶液A、B中由水电离出的c(H+):A>B
【答案】C
【解析】
A.升高温度正逆反应速率均是增大的,则用图①不能表示对某化学平衡体系改变温度后反应速率随时间的变化,故A错误;
B.氯化铝水解生成氢氧化铝和氯化氢,水解吸热且生成的氯化氢易挥发,直接加热蒸发氯化铝溶液得不到氯化铝晶体,而是得到氢氧化铝,故B错误;
C.明矾的化学式为KAl(SO4)2,向明矾溶液中加入一定浓度的氢氧化钡溶液生成硫酸钡和氢氧化铝沉淀,当硫酸根完全转化为硫酸钡沉淀时,铝离子恰好转化为偏铝酸盐,即氢氧化铝的质量先增大后减小,因此图③可以表示向一定量的明矾溶液中逐滴滴加一定浓度氢氧化钡溶液时产生Al(OH)3沉淀的物质的量变化,故C正确;
D.图④电解饱和食盐水的装置中钠离子向左侧移动,则左侧电极是阴极,氢离子放电生成氢气,同时产生氢氧化钠,抑制水的电离。右侧是氯离子放电生成氯气,溶液A、B中由水电离出的c(H+):A<B,故D错误;
故选C。

 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案【题目】用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g) ![]() N2(g)+CO2(g)。
N2(g)+CO2(g)。
(1)写出上述反应的平衡常数表达式_______________。
(2)在2L恒容密闭器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
①结合表中数据,判断该反应的△H____0(填“>”或“<”),理由是_________。
②判断该反应达到平衡的依据是_______。
A.容器内气体密度恒定 B.容器内各气体浓度恒定
C.容器内压强恒定 D.2v正(NO)= v逆(N2)
(3)700℃时,若向2L体积恒定的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g)![]() C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。

①0~10 min内的CO2平均反应速率v=____________。
②图中A点v(正)___v(逆)(填“>”、“<”或“=”)。
③第10 min时,外界改变的条件可能是_____________。
A.加催化剂 B.增大C的物质的量
C.减小CO2的物质的量 D.升温 E.降温