题目内容
磷在氧气中燃烧,可能生成两种固态氧化物.3.1 g的单质磷(P)在3.2 g氧气中燃烧,至反应物耗尽,并放出X kJ热量.
(1)通过计算确定反应物的组成(用化学式表示)是_________,其相应的质量(g)为_________.
(2)已知单质磷的燃烧热为Y kJ·mol-1,则1 mol P与O2反应生成固态P2O3的反应热ΔH=_________.
(3)写出1 mol P与O2反应生成固态P2O3的热化学方程式:_________.
答案:
解析:
解析:
|
答案:(1)P2O3、P2O5 2.75、3.55 (2)-(20X-Y)kJ·mol-1 (3)P(s)+3/4O2(g) 解析:本题以磷的燃烧为载体,考查反应热、盖斯定律及热化学方程式的有关知识.由题意知生成的两种氧化物分别为P2O3和P2O5,设生成P2O3和P2O5所需的P物质的量分别为x、y.根据方程式4P+3O2 |

练习册系列答案
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案
相关题目
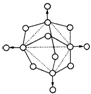 磷在空气中充分燃烧,生成X的分子结构如右图所示.图中实线表示化学键,圆圈表示原子(不考虑原子体积大小)
磷在空气中充分燃烧,生成X的分子结构如右图所示.图中实线表示化学键,圆圈表示原子(不考虑原子体积大小)