题目内容
29.磷在氧气中燃烧,可能生成两种固态氧化物。3.1 g的单质磷(P)在3.2 g氧气中燃烧,至反应物耗尽,并放出X kJ热量。(1)通过计算确定反应产物的组成(用化学式表示)是 ,其相应的质量(g)为 。
(2)已知单质磷的燃烧热为Y kJ/mol,则1mol P与O2反应生成固态P2O3的反应热ΔH= 。
(3)写出1mol P与O2反应生成固态P2O3的热化学方程式: 。
答案:
(1)P2O3 P2O5 2.75 3.55
(2)-(20X-Y)kJ/mol
(3)P(s)+![]() O2(g)=
O2(g)=![]() P2O2(s);
P2O2(s);![]() △H=-(20X-Y)kJ/mol
△H=-(20X-Y)kJ/mol
解析:3.1 g P在3.2 g O2中充分燃烧后,产物中n(P)∶n(O)=1∶2,可知其中必然有P2O5,另一种固态氧化物为P2O3。列出方程组:
![]()
解得:n(P2O5)=0.025 mol,n(P2O3)=0.025 mol,质量分别为3.55 g和2.75 g。
P的燃烧热是1 mol P充分燃烧生成P2O5时放出的热量,则1 mol P与O2反应生成固态P2O3时放出的热量为:![]() =(20x-y) kJ,即反应热ΔH=-(20x-y)kJ·mol-1。
=(20x-y) kJ,即反应热ΔH=-(20x-y)kJ·mol-1。
热化学方程式为:P(s)+![]() O2(g)====
O2(g)====![]() P2O3(s);ΔH=-(20x-y)kJ·mol-1
P2O3(s);ΔH=-(20x-y)kJ·mol-1

练习册系列答案
相关题目
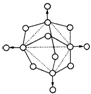 磷在空气中充分燃烧,生成X的分子结构如右图所示.图中实线表示化学键,圆圈表示原子(不考虑原子体积大小)
磷在空气中充分燃烧,生成X的分子结构如右图所示.图中实线表示化学键,圆圈表示原子(不考虑原子体积大小)