题目内容
在Fe3++3H2O ?Fe(OH)3+ 3H+的平衡体系中,要使平衡向水解方向移动且使溶液的pH值增大,可采取的措施为
- A.加热
- B.通HCl气体
- C.加入FeCl3(固体)
- D.加入CuO(固体)
D
本题为Fe3+的水解平衡,升高温度、减小浓度会使平衡右移。A加热使平衡右移H+浓度增大,pH减小;B能入HCl气体导致酸性增强,平衡左移,pH减小;C会增加Fe3+浓度,导致H+浓度增大,pH减小;D中CuO可消耗H+使平衡右移,同时pH值增大,故答案为D。
本题为Fe3+的水解平衡,升高温度、减小浓度会使平衡右移。A加热使平衡右移H+浓度增大,pH减小;B能入HCl气体导致酸性增强,平衡左移,pH减小;C会增加Fe3+浓度,导致H+浓度增大,pH减小;D中CuO可消耗H+使平衡右移,同时pH值增大,故答案为D。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

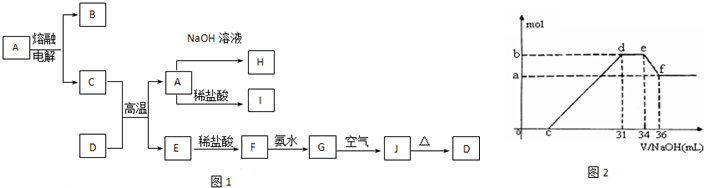
 (2010?南宁二模)A、B、C、D、E、F六种物质的相互转化关系如图1所示(反应条件未标出),其中反应①是置换反应.②为化合反应.
(2010?南宁二模)A、B、C、D、E、F六种物质的相互转化关系如图1所示(反应条件未标出),其中反应①是置换反应.②为化合反应. Fe(OH)3 + 3H+的平衡体系中,要使平衡向水解方向移动且使溶液的pH值增大,可采取的措施为
Fe(OH)3 + 3H+的平衡体系中,要使平衡向水解方向移动且使溶液的pH值增大,可采取的措施为