题目内容
①酸的浓度和体积;②碱的浓度和体积;③比热容:④反应后溶液的质量;⑤生成水的物质的量;⑥反应前后温度变化;⑦操作所需的时间。
A. ③④⑤⑥ B. ①③④⑤ C. ①②③⑥ D. 全部
 阅读快车系列答案
阅读快车系列答案(1)常温常压下,依据事实,写出下列反应的热化学方程式。
①在25℃、101kPa下,2g甲醇燃烧生成CO2和液态水时放热45kJ。则表示甲醇燃烧热 的热化学方程式为______________________。
的热化学方程式为______________________。
②若适量的N2和O2完全反应,每生成23g NO2需要吸收17kJ热量__________________。
(2)断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol(理想)气体分子化学键所放出的能量称为键能(单位为KJ.mol-1)下表是一些键能数据(KJ·mol-1)
化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
C—H | 414 | C—F | 489 | H—F | 565 | F—F | 158 |
H-H | 436 | H-N | 391 |
①根据键能数据计算以下反应的反应热△H:
CH4(g)+4F2(g)﹦CF4(g)+4HF(g) △H
②根据键能和反应热化学方程式1/2N2(g)+3/2H2(g) =NH3(g ) △H = —46 kJ·mol -1 计算N≡N的键能。
-1 计算N≡N的键能。
(3)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256kJ的热量(25℃、101 kPa下测得的热量)。
①该反应的热化学方程式为 。
②又已知H2O(l) =H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
测定中和反应的反应热的实验步骤如下:
①用量筒量取50ml0.25mol/L硫酸倒入小烧杯中,测出硫酸溶液温度
②用另一量筒量取50ml0.55mol/LNaOH溶液,并测出其温度
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度
回答下列问题:
(1)倒入NaOH溶液的正确操作是 。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使硫酸与NaOH溶液混合均匀的正确操作是 。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(3)实验数据如下表:
温度 溶液 试验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | |
2 | 25.9 | 25.9 | 25.9 | 29.2 | |
3 | 26.4 | 26.2 | 26.3 | 29.8 | |
近似认为0.55mol/LNaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3,中和后混合溶液的比热容c=4.18J/(g·℃)。利用上表数据计算该中和反应的反应热△H= (保留一位小数);写出上述中和热的热化学方程式 。
②利用上表数据计算出的中和热与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.量取NaOH溶液的体积时仰视读数
d.分多次把NaOH溶液倒入盛有硫酸的小烧杯中


 CH3O
CH3O CH3(g) + H2O(g) ΔH=-23.5kJ·mol-1。在t1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
CH3(g) + H2O(g) ΔH=-23.5kJ·mol-1。在t1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
 知可逆反应:M(g)+N(g)
知可逆反应:M(g)+N(g) 
 Ag(NH3)2+(aq) k1=1.10×107
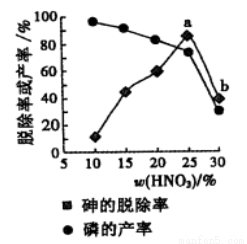
Ag(NH3)2+(aq) k1=1.10×107 2Cl2(g)+2H2O(g),下图是两种投料比[n(HCl):(O2)分别为4:1和2:1]下,反应温度对HCl平衡转化率影响的曲线。则投料比为4:1、溺度为400℃时,平衡混合物中Cl2的体积分数是( )
2Cl2(g)+2H2O(g),下图是两种投料比[n(HCl):(O2)分别为4:1和2:1]下,反应温度对HCl平衡转化率影响的曲线。则投料比为4:1、溺度为400℃时,平衡混合物中Cl2的体积分数是( )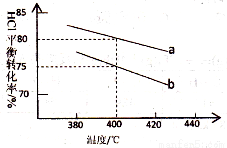
 B.
B.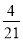 C.
C.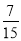 D.
D.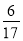
 烯(C60)的结构如图甲,分子中碳原子轨道的杂化类型为 ;1mol C60分子中σ键的数目为 个.
烯(C60)的结构如图甲,分子中碳原子轨道的杂化类型为 ;1mol C60分子中σ键的数目为 个.
 数目为8NA
数目为8NA