题目内容
15.欲实现下列实验目的,进行的实验操作合理的是( )| 实验目的 | 实验操作 | |
| A | 证明乙二酸具有还原性 | 向乙二酸溶液中滴加2 滴KMnO4溶液 |
| B | 制备Fe(OH)3胶体 | 将NaOH溶液滴加到饱和FeCl3溶液中 |
| C | 铝可以从铜盐溶液中置换铜 | 将久置在空气中的铝片放入CuSO4溶液中 |
| D | 检验蔗糖是否水解 | 取蔗糖溶液,加3~5滴稀硫酸,水浴加热5min,取少量溶液,加入银氨溶液加热 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.乙二酸能被高锰酸钾氧化;
B.NaOH溶液滴加到饱和FeCl3溶液中,发生复分解反应生成沉淀;
C.久置在空气中的铝片,表面有氧化铝;
D.蔗糖水解生成葡萄糖,检验葡萄糖应在碱性条件下.
解答 解:A.乙二酸能被高锰酸钾氧化,溶液褪色,可说明乙二酸具有还原性,故A正确;
B.NaOH溶液滴加到饱和FeCl3溶液中,发生复分解反应生成沉淀,应水解制备胶体,故B错误;
C.久置在空气中的铝片,表面有氧化铝,氧化铝与CuSO4溶液不反应,故C错误;
D.蔗糖水解生成葡萄糖,检验葡萄糖应在碱性条件下,没有加碱至碱性不能检验葡萄糖,则不能说明水解,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应与现象、物质的鉴别为解答关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
5.可用分液漏斗分离的一组混合物是( )
| A. | 硝基苯和酒精 | B. | 溴苯和溴 | C. | 甲苯和苯 | D. | 硝基苯和水 |
3.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1L 0.1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 4.6g Na在空气中完全反应生成Na2O、Na2O2,转移0.2 NA个电子 | |
| C. | 标准状况下,将22.4L Cl2通入水中发生反应,转移的电子数为NA | |
| D. | 100g 46%的乙醇溶液中,含H-O键的数目为NA |
10.化学与生活、能源、环科技等密切相关.下列描述错误的是( )
| A. | 在厨房里用米汤不能直接检验食盐中是否含有碘 | |
| B. | 煤炭经过干馏,可获得相对清洁的能源和重要的化工原料 | |
| C. | 利用风能、太阳能等清洁能源代替化石燃料,可减少环境污染 | |
| D. | 水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键 |
20.设NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 12g石墨烯(  )中含有C-C键的数目为1.5NA )中含有C-C键的数目为1.5NA | |
| B. | 100g质量分数为17%的H2O2水溶液中含氧原子数目为0.5NA | |
| C. | 常温下,1 L0.5 mol/L NH4Cl溶液与2 L0.25 mol/L NH4Cl溶液所含NH4+的数目均为0.5 NA | |
| D. | 在KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O反应中,每生成1 mol Cl2转移的电子数为2NA |
7.A、B、C、D、E为原子序数依次增大的五种短周期元素,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构.A和B、D、E均能形成共价型化合物.A和B,C和E形成的化合物在水中均呈碱性.下列说法正确的是( )
| A. | 简单阳离子的氧化性:A<C | |
| B. | 可用含氧酸的酸性比较B、D元素的非金属性 | |
| C. | 简单离子半径:C>D>E>B | |
| D. | A、C、E三种元素形成的化合物既还有离子键又含有共价键 |
4.分子式为C10H14且苯环上的一氯代物有两种的有机物有( )
| A. | 3种 | B. | 5种 | C. | 6种 | D. | 7种 |
19.图甲是利用一种微生物将废水中的尿素【CO(NH2)2】的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中正确的是( )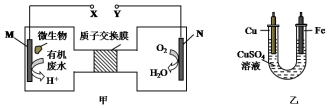

| A. | N为正极,铁电极应与Y相连接 | |
| B. | M电极反应式:CO(NH2)2+H2O-6e-═CO2↑+N2↑+6H+ | |
| C. | 当N电极消耗0.25 mol气体时,则铁电极增重16 g | |
| D. | H十透过质子交换膜由右向左移动 |
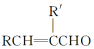 +H2O
+H2O ;E中含氧官能团的名称:羧基.
;E中含氧官能团的名称:羧基. +
+ $→_{加热}^{浓硫酸}$
$→_{加热}^{浓硫酸}$ +H2O.
+H2O.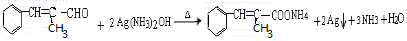 .
. .
.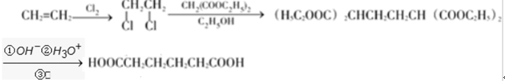 .
.